
【题目】下列关于单质硫的说法中,不正确的是
A.硫在过量纯氧中燃烧的产物是三氧化硫B.试管内壁附着的硫可用二硫化碳溶解除去
C.硫跟铁反应生成硫化亚铁D.单质硫既有氧化性,又有还原性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
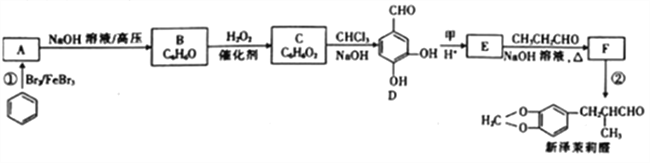
已知:①RCHO+R'CH2CHO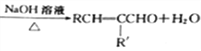
②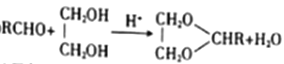
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备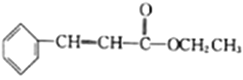 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙烯分子结构的描述错误的是
A.乙烯的结构简式为CH2=CH2B.乙烯是最简单的烯烃
C.乙烯分子中所有原子都在同一平面上D.乙烯分子中所有原子都在一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于分子晶体的是( )
A. 熔点是10.31℃,液态不导电,水溶液能导电
B. 熔点是1070℃,固态不导电,熔融状态能导电,易溶于水
C. 熔点3550℃,不溶于水,不导电
D. 熔点是97.80℃,质软,固态可导电,密度是0.97g·cm﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
①流程中先加双氧水的目的是__________________________________________。
②加氨水调节溶液的pH等于6,则滤渣的成分是__________________,滤液中含有的阳离子有H+ 和___________________。
(3)在浸出液里锰元素只以Mn2+ 的形式存在,且滤渣中也无MnO2,请解释原因_________。
(4)阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,则A电极是______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__________________________。

(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com