
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
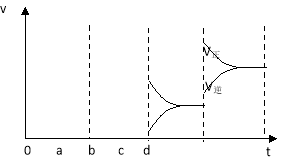
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.
2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.

【答案】(1)2mol/(L·min);1mol/(L·min); 2mol/L
(2)升温;减小 SO3 浓度;
【解析】
试题分析:(1)2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=(6-2)mol/L/2min=2mol/(L*min),用O2浓度变化来表示的反应速率为:v(O2)=1/2*2mol/(L*min)=1mol/(L*min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L*min),二氧化硫的反应速率为:v(SO2)=2v(O2)=2*0.5mol/(L*min)=1mol/(L*min),反应消耗的二氧化硫的物质的量浓度为:n()=1mol/(L*min)*2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为: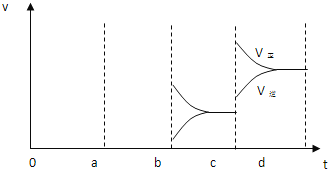 ,
,
因此,本题正确答案是:升高温度;减小SO3浓度;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲苯的一氯代物有三种同分异构体
B. 乙醇能使高锰酸钾溶液褪色
C. 乙烯、苯、乙酸分子中的所有原子都在同一个平面上
D. C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测不正确的是( )

A.实验Ⅰ:振荡后静置,上层溶液变为无色
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在试管中加入2~3mL液体再加热,正确的操作顺序是( )
①点燃酒精灯进行加热;②在试管中加入2~3mL液体;③用试管夹夹持在试管的中上部;④将试剂瓶的瓶盖盖好,放在原处.
A.②③④①
B.③②④①
C.②④③①
D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是( )
A.2H2O2![]() 2H2O+O2↑
2H2O+O2↑
B.2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
C.FeO+2HCl=FeCl2+H2O
D.CuCl2+2NaOH=Cu(OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。已知H2O(l) = H2O(g) ΔH = +44 kJ·mol-1 ,则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com