
【题目】化学电池在通迅、交通及日常生活中有着广泛的应用。
(1)如图是锌锰干电池的基本构造图。
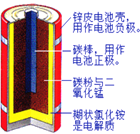
①该干电池工作时负极上的电极反应式是_______________MnO2的作用是除去正极上的产物H2,本身生成Mn2O3,该反应的化学方程式是______________。
②关于该电池的使用和性能,说法正确的是 (______)
A.该电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
D.外电路中每通过0.2mol电子,负极的质量理论上减小6.5g
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: Cd +2NiO(OH)+2H2O 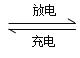 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
A .以上反应是可逆反应 B.以上反应不是可逆反应
C. 电池放电时Cd 做负极 D. 电池放电时Cd 做正极
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米的耕地失去使用价值。在酸性土壤中这种污染更为严重这是因为___________。
(4)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,一般使用时间可长达十年,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因___________。
【答案】Zn-2e-=Zn2+ 2MnO2+H2=Mn2O3+H2O BD BC 金属镍镉都可与酸反应生成重金属离子 2Li +2H2O =2LiOH + H2↑
【解析】
(1)①锌锰干电池中负极材料是锌,电极反应式为Zn-2e-=Zn2+;正极上发生还原反应;
②A.干电池属于一次电池;
B.该电池可用于闹钟、收音机、照相机等;
C.该电池会污染环境;
D.外电路中每通过0.2mol电子,消耗的Zn的物质的量为0.1mol,所以锌的质量理论上减小6.5g;
(2)放电时Cd失电子,作负极,发生氧化反应,NiO(OH)得电子作正极,发生还原反应,据此判断;
(3)金属镍镉都可与酸反应生成重金属离子,污染土壤和水等环境;
(4)锂是活泼金属,极易与水反应。
(1)①锌锰干电池中,锌易失电子发生氧化反应而作负极,所以负极材料是Zn,负极上电极反应式为Zn-2e-=Zn2+,MnO2的作用是除去正极上的产物H2,本身生成Mn2O3,该反应的化学方程式是2MnO2+H2=Mn2O3+H2O
故答案为:Zn-2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
②A.该电池属于一次电池,不能反复使用,故A错误;
B.该电池中产生的电能较少,所以可用于闹钟、收音机、照相机等,故B正确;
C.该电池中含有酸性物质、锰等金属,会污染地下水和土壤,所以不能焚烧、埋入土壤,故C错误;
D.负极反应式为Zn-2e-=Zn2+,外电路中每通过0.2mol电子,锌的质量理论上减小质量=
![]() =6.5g,故D正确;
=6.5g,故D正确;
故答案为:BD;
(2)放电时,负极上Cd失电子发生了氧化反应,反应为Cd+2OH--2e-═Cd(OH)2,NiO(OH)得电子作正极,发生还原反应,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,
A .以上反应的反应条件不同,不是可逆反应,故A错误;
B.由A分析可知,以上反应不是可逆反应,故B正确;
C. 电池放电时Cd做负极,失电子发生了氧化反应,故C正确;
D. 由C可知电池放电时Cd做负极,故D错误;
故选BC。
(3)金属镍和镉都是较活泼的金属,都可与酸反应生成重金属离子,污染土壤和水等环境;故答案为:金属镍镉都可与酸反应生成重金属离子;
(4)锂是活泼金属,极易与水反应,用化学方程式表示不能用水溶液的原因:2Li +2H2O =2LiOH + H2↑。故答案为:2Li +2H2O =2LiOH + H2↑。


科目:高中化学 来源: 题型:
【题目】短周期中8种元素a-h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。
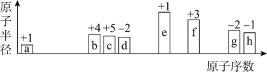
下列判断不正确的是
A.a、d、f组成的化合物能溶于强碱溶液
B.a可分别与b或c组成含10个电子的分子
C.e的阳离子与g的阴离子具有相同的电子层结构
D.最高价氧化物对应水化物的酸性:h>g>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图判断,下列说法不正确的是( )
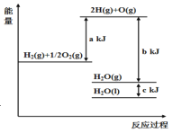
A. 1 mol H2(g)与![]() mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高
mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高
B. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
C.2 mol H2(g)与1mol O2(g)生成1 mol H2O(g)所放出的热量是bkJ
D.液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g) △H=2(b+c-a)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
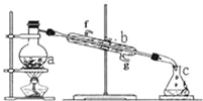
(1)写出下列仪器的名称:a.__b.__。
(2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母)。
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__。
(4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(![]() )氮原子上的氢原子可以像苯酚分子中苯环上的氢原子那样与甲醛发生反应,生成交联脲醛树脂,其结构片段如下图所示(图中 表示链延长)。
)氮原子上的氢原子可以像苯酚分子中苯环上的氢原子那样与甲醛发生反应,生成交联脲醛树脂,其结构片段如下图所示(图中 表示链延长)。
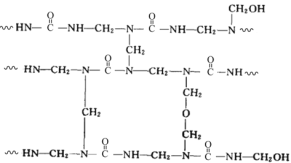
下列说法不正确的是
A.尿素可以与甲醛发生加成反应生成 ![]()
B.脲醛树脂的合成反应为缩聚反应
C.交联脲醛树脂在一定条件下可以发生水解反应,重新生成尿素和甲醛
D.甲醛可以与![]() 交联成网状结构的脲醛树脂
交联成网状结构的脲醛树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol MnO2加到10mL过氧化氢(H2O2)的水溶液里(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图:
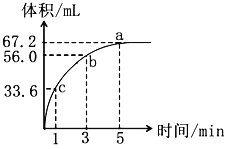
(1)a、b、c三点反应速率快慢顺序为_______,反应速率变化的可能原因是______________。
(2)计算过氧化氢的起始物质的量浓度是多少?_______________
(3)假设反应过程中溶液的体积保持不变,则用H2O2表示该反应1—3分钟内的平均速率为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )的说法错误的是
)的说法错误的是
A. a、b、c互为同分异构体
B. a、c均能使酸性高锰酸钾溶液褪色
C. a、c与足量氢气反应消耗氢气的物质的量之比是4∶3
D. a、b、c的一氯代物分别有4种、1种、2种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中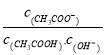 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com