
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
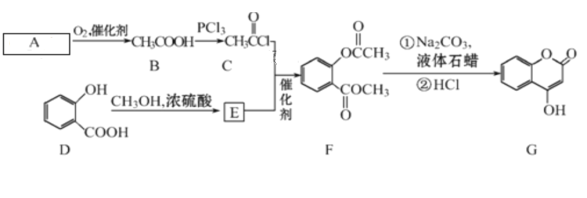
请回答:
(1)A 的结构简式________,在A→B的反应中,检验A是否反应完全的试剂为_________。
(2)C+E→F的反应类型是____,F中含有的官能团名称为________。
(3)写出G和过量NaOH溶液共热时反应的化学方程式____________。
(4)化合物E的同分异构体很多,符合下列条件的结构共有___种,①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应;④不含-OCO-结构。所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
【答案】CH3CHO 银氨溶液或新制氢氧化铜悬浊液 取代反应 酯基 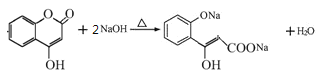 9 c
9 c 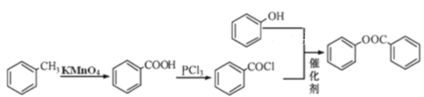
【解析】
根据流程可知,A与氧气在催化剂的条件下生成乙酸,则A为乙醛;邻羟基苯甲酸与甲醇在浓硫酸加热的条件下发生酯化反应,生成E,则E为邻羟基苯甲酸甲酯(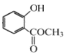 )。
)。
(1)分析可知,A为乙醛,其结构简式为CH3CHO;检验乙醛未完全反应时,则存在的官能团为醛基,可用银氨溶液或新制的氢氧化铜检验;
(2)已知E为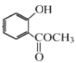 ,与C反应生成F,结合结构特点,反应类型为取代反应;F中含有的官能团为酯基;
,与C反应生成F,结合结构特点,反应类型为取代反应;F中含有的官能团为酯基;
(3)G中含有酯基,在NaOH溶液中酯基断裂,生成的酚羟基也能与NaOH反应,则方程式为![]() +2NaOH
+2NaOH![]()
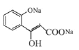
![]() H2O;
H2O;
(4)化合物E为 ,分子式为C8H8O3,其同分异构体①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应,即含有羧基;④不含-OCO-结构,则苯环上的取代基为-OH、-CH2COOH;-CH2OH、-COOH;-OCH3、-COOH三组,各有邻、间、对三种,合计9种;
,分子式为C8H8O3,其同分异构体①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应,即含有羧基;④不含-OCO-结构,则苯环上的取代基为-OH、-CH2COOH;-CH2OH、-COOH;-OCH3、-COOH三组,各有邻、间、对三种,合计9种;
a.质谱仪能记录分子离子、碎片离子的相对质量,质谱图中数值最大的即是该分子的相对分子质量,不符合题意,a错误;
b.红外光谱仪检测有机物中特殊官能团及机构特征,主要适用于定性分析有机化合物结构,不符合题意,b错误;
c.元素分析仪用于元素分析仪来确定有机化合物中的元素组成,符合题意,c正确;
d.核磁共振仪测出有机物中氢原子子的种类以及数目之比,不符合题意,d错误;
答案为c;
(5)根据流程可知,甲苯与酸性高锰酸钾反应生成苯甲酸,苯甲酸与PCl3反应生成![]() ,再与苯酚反应生成苯甲酸苯酚酯,流程为
,再与苯酚反应生成苯甲酸苯酚酯,流程为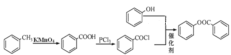 。
。


科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。

①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
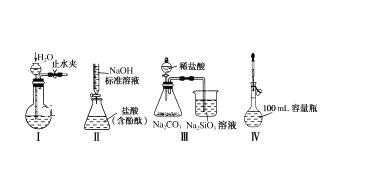
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2、O2、Cl2三种气体,按质量比为18∶128∶71混合,盛在密闭容器中用电火花引爆,充分反应后经冷却、液化,所得溶液中溶质的质量分数为( )
A.37%B.33.6%C.18.5%D.16.8%
查看答案和解析>>
科目:高中化学 来源: 题型:
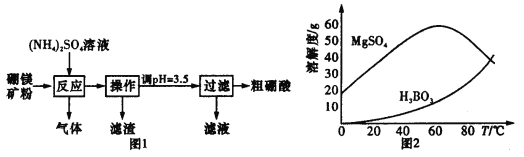
【题目】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。
请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
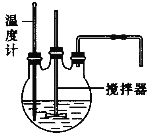
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________。
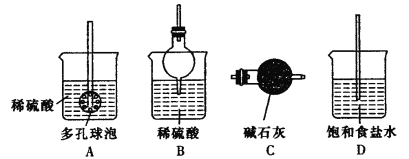
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________(填字母代号)。
(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:
(1)用pH试纸检验,该溶液呈强酸性;
(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;
(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_____________,可能存在的离子是__________________。你推断的理由是______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com