
【题目】(1)7.8g Na2R含有0.2mol Na+,则Na2R的摩尔质量为______
(2)将4g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为______.
(3)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为______.
(4)标准状况下,3.4g NH3与标准状况下______LH2S含有相同数目的氢原子。
(5)同温同压,等质量的O2和SO2,它们的物质的量之比为______,所含原子数之比为______,密度之比______.
(6)标准状况下,将VL HCl气体溶于100mL水(密度是1g/mL)中,所得溶液密度为ρg/mL,则此盐酸的物质的量浓度为______.
【答案】78g/mol 0.1mol/L aNA/b 6.72L 2:1 4:3 1:2 ![]()
【解析】
(1)根据M=![]() 计算;
计算;
(2)根据c=![]() 计算,根据溶液是均一体系分析;
计算,根据溶液是均一体系分析;
(3)根据n=![]() =
= ![]() 分析;
分析;
(4)根据n=![]() =
= ![]() =
= ![]() 计算。
计算。
(5)根据同温同压下,等质量的气体,摩尔质量和物质的量成反比,密度和摩尔质量成正比分析。
(1)7.8g Na2R含有0.2mol Na+,根据钠离子计算的Na2R物质的量为0.1mol,则其摩尔质量为![]() ;
;
(2)4克氢氧化钠溶解在10mL水中稀释成1L溶液,物质的量浓度为0.1mol/L,从中取出10mL,浓度不变,仍为0.1mol/L;
(3)假设气体的摩尔质量为Mg/mol,则有![]() ,则计算M= aNA/b。
,则计算M= aNA/b。
(4)3.4克氨气的物质的量为![]() ,含有0.6mol氢原子,则对应的硫化氢的物质的量为0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L。
,含有0.6mol氢原子,则对应的硫化氢的物质的量为0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L。
(5)氧气和二氧化硫的摩尔质量分别为:32g/mol、64 g/mol;同温同压下,等质量的氧气和二氧化硫,物质的量比等于摩尔质量的反比,即为64:32=2:1,所含原子数比为2×2:1×3=4:3,密度比等于摩尔质量之比,即为32:64=1:2。
(6)氯化氢的物质的量为![]() ,溶液的质量为
,溶液的质量为![]() ,溶液的体积为
,溶液的体积为![]() L,物质的量浓度为
L,物质的量浓度为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
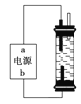
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平该反应的化学方程式:___
① FeSO4+ KMnO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
②该反应中的氧化剂是___,氧化产物是____。
③若消耗3.16gKMnO4,则该反应转移的电子数目为____。
(2)已知反应:①Cl2+2KBr=2KCl+Br2,②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,③Br2+K2S=2KBr+S。
①下列说法正确的是__。
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KMnO4>Cl2>Br2>S
C.反应②中还原剂与氧化剂的物质的量之比为8:1
D.反应③中1mol还原剂被氧化则转移电子的物质的量为2mol
②用单线桥法标出反应②中电子转移的方向和数目___。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液,pH的变化曲线如图所示。下列说法不正确的是
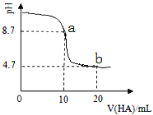
A. pH=4.7时,2c(Na+) = c(A-)+ c(HA)
B. 一元酸HA为弱酸
C. a、b两点所示溶液中水的电离程度不同,且a点比b点电离程度大
D. a点所示溶液中c(A-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式正确的是
A.CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
B.2![]() +3Br2→2
+3Br2→2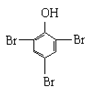 ↓
↓
C.n CH2=CH—CH3 ![]()
![]()
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某物质X(仅含两种元素)的组成和性质,设计并完成如下实验。(气体体积已转化为标况体积)
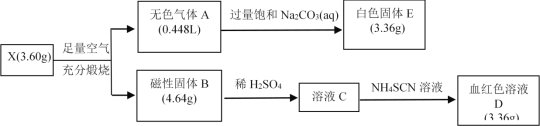
请回答下列问题:
(1)X的化学式为___________。
(2)A的结构式为________,E属于_______化合物(填离子或共价)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(只含MnO2和MnO)、H2SO4(过量)和FeS2制备MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反应):

(1)已知①中只有三个反应,其中两个反应是
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S↑+S↓
完成第三个反应:
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
(2)沉淀A、B的化学式分别是____________________、__________________。
(3)滤液X中的溶质有__________;实验室中浓缩滤液Y时使用的玻璃仪器有___________________。
(4)若得到的沉淀A的质量和MnSO4·H2O的质量分别为96.0 g、321.1 g,②中加入的MnO为0.1 mol,则理论上软锰矿中MnO2和MnO的物质的量之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com