
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.常温常压下,1.5g甲基(-CH3)中含有的电子数为NA
B.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
C.常温下,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
D.0.lmol环氧乙烷(![]() )中含有的共价键数为0.3NA
)中含有的共价键数为0.3NA
【答案】B
【解析】
A.常温常压下,一个-CH3中含有9个电子,1.5g甲基(-CH3)为![]() =0.1mol,含有的电子数为0.9NA,故A错误;
=0.1mol,含有的电子数为0.9NA,故A错误;
B.Cu只能和浓硫酸反应,和稀硫酸不反应,0.2mol的浓硫酸不能反应完全,则生成SO2的分子数小于0.1NA,转移电子数小于0.2NA,故B正确;
C.常温下,1LpH=9的CH3COONa溶液中c(H+)=10-9mol/L,水电离的氢氧根离子浓度为c(OH-)=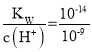 =10-5mol/L,根据H2OH++OH-,则发生电离的水分子数为1L×10-5 mol/L×NA=1×10-5NA,故C错误;
=10-5mol/L,根据H2OH++OH-,则发生电离的水分子数为1L×10-5 mol/L×NA=1×10-5NA,故C错误;
D.一个环氧乙烷分子中中含7个共价键,则0.1mol环氧乙烷中含有的共价键数为0.1mol ×7×NA =0.7NA,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需__________________ 、______________________。
(2)取10.00mL待测液,用___________________量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶,直到看到_________即可判断达到滴定终点。
(4)根据下列数据,计算待测烧碱溶液的浓度为:___________(结果保留四位有效数字)。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)滴定过程,下列情况会使测定结果偏高的是____________________(填序号)。
①酸式滴定管用水洗后便装液体进行滴定;
②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧记录起始体积时,仰视读数,终点时俯视。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
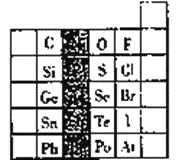
(1)阴影部分元素在元素周期表中的位置为第_________族。根据元素周期律、预测;酸性强弱H3AsO4______H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,请按要求回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(1)A-I中元素,化学性质最不活泼的是______(用元素符号),还原性最强的单质是______(用元素符号);
(2)A-I中最高价氧化物的水化物酸性最强的酸是______(用化学式);
(3)用电子式表示D元素最高价氧化物的形成过程_______________________________ ;
D元素最高价氧化物的结构式为______
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式___________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+216.4kJ/mol
CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=–41.2kJ/mol
CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)H=__。
CO2(g)+4H2(g)H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 保持不变
保持不变
D.![]() =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺(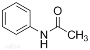 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(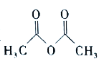 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):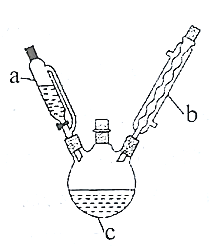
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)过量乙酸酐放入三颈烧瓶c中,在a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三颈烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用__洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,__、洗涤、干燥后称量产品为5.40g。
回答下列问题:
(1)仪器b的名称是__。
(2)步骤I中,减压过滤的优点是过滤速度快,同时所得固体更干燥,用滤液而不用蒸馏水冲洗烧杯的原因是__;洗涤晶体最好选用__(填字母)。
A.乙醇 B.CCl4 C.冷水 D.乙醚
(3)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是__。
(4)步骤Ⅱ中,洗涤干燥前的操作是___。上述提纯乙酰苯胺的方法叫__。
(5)乙酰苯胺的产率为___。(计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等合金金属作为主电极,借助外加脉冲高电压作用产生电化学反应,把电能转化为化学能,以牺牲阳极金属电极产生金属阳离子絮凝剂,通过凝聚、浮除、还原和氧化分解将污染物从水体中分离,从而达到净化水体的目的。下列说法正确的是( )
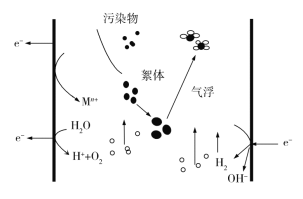
A.右极为阳极,左极为阴极
B.电子从左极经电解液流入右极
C.每产生1 mol O2,整个电解池中理论上转移电子数为4NA
D.若铁为阳极,则在处理废水过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
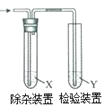
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com