
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )

A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
【答案】B
【解析】
A.常温下,未加盐酸的氨水的-lgc水(H+)=11,则该溶液中水电离出的c(H+)=c(OH-)=10-11mol/L,溶液中c(OH-)=![]() mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=
mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=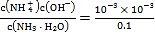 =1×10-5,A错误;
=1×10-5,A错误;
B.当-lgc水(H+)最小时,HCl与氨水恰好完全反应,所以b点NaOH溶液体积为20.00mL,B正确;
C. N点水电离出的H+浓度最大,溶液呈中性,R点碱过量,溶液呈碱性。Q点溶质为HCl和NH4Cl,溶液呈酸性,C错误;
D.R点氨水略过量,R→N加HCl消耗一水合氨,促进水的电离;N→Q加HCl,酸过量,抑制水的的电离,所以R到N、N到Q所加盐酸体积不相等,D错误;
故合理选项是B。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中充入2a(a>0)molH2和a mol CO,在一定条件下合成甲醇,CO(g)+2H2(g)CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
①在该温度下,平衡常数K=____ (用代数式表示)。
②在该温度下,向此平衡体系中加入a mol CH3OH(g),再次达到平衡后CO的体积分数将____(填“增大”“减小”或“不变”)
③下列情况表明反应达到平衡状态的是____
A.![]() 不再改变
不再改变
B.CO的消耗速率等于CH3OH的生成速率
C.混合气体的密度不再改变
D.混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL ![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电性变化如下图。下列分析不正确的是
溶液,所得溶液pH及导电性变化如下图。下列分析不正确的是![]()
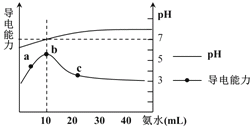
A.![]() 点导电能力增强说明HR为弱酸
点导电能力增强说明HR为弱酸
B.b点溶液![]() 说明
说明![]() 没有水解
没有水解
C.c 点溶液存在![]() 、
、![]()
D.![]() 任意点溶液均有
任意点溶液均有![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黑(Fe3O4)是常见的铁系颜料。一种制取铁黑的实验流程如图所示:

制取铁黑的反应原理可表示为:![]()
(1)保存FeSO4溶液时,常在试剂瓶中加入铁粉,其目的是______________________________。
(2)加入氨水调pH时,发生反应的离子方程式_______________________________________。
(3)Fe(OH)2在空气被氧化为Fe(OH)3,写出反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
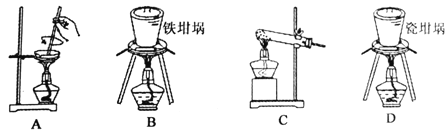
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
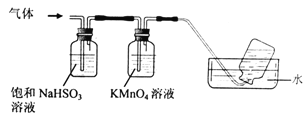
①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
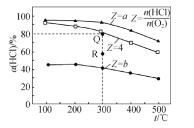
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)![]() 和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为______,它属于_____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加入___________
溶液中加入___________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ;
;
(5)将铝粉和氧化铁的混合物点燃,反应放出大量的热量,生成的液态的铁用来焊接铁轨。请写出反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同条件下利用N2+3H2==2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是 ( )
A. v(H2)=0.1 mol·(L·min)1B. v(N2)=0.01 mol·(L·s)1
C. v(N2)=0.2 mol·(L·min)1D. v(NH3)=0.3 mol·(L·min)1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com