
【题目】某结晶水合物分子式为RnH2O,其相对分子质量为M,25℃时,a g晶体溶于b g水中即饱和,形成V ml密度为ρ g/cm3的溶液,下列不正确的是 ( )
A. 饱和溶液的质量分数为![]() B. 25℃,R的溶解度为
B. 25℃,R的溶解度为![]() g
g
C. 饱和溶液的质量分数为![]() D. 饱和溶液物质的量浓度为
D. 饱和溶液物质的量浓度为![]() mol/L
mol/L
【答案】B
【解析】
晶体的物质的量为a/M mol,溶质的质量为a(M-18n)/M g;溶液的质量为(a+b)g 或ρV g,溶液的体积为V mL,
A. 溶质的质量为(a-a×18n/M)g,溶液质量ρV g;所以饱和溶液的质量分数为(a-a×18n/M)÷ρV×100%=a(M-18n)/ρV×100%=![]() ,故A正确;
,故A正确;
B.设25℃时,A的溶解度为S,则S/(100+S)= [a(M-18n)/M]/(a+b),R的溶解度为:S=100a(M-18n)/(bM+18an),故B错误;
C. 溶质的质量为(a-a×18n/M)g,溶液质量为(a+b)g;所以饱和溶液的质量分数为=(a-a×18n/M)÷(a+b)×100%=![]() ,故C正确;
,故C正确;
D.晶体的物质的量为a/M mol,则溶质的物质的量为a/M mol,溶液的体积为V mL=V×10-3L;根据c=n/V可知,饱和溶液物质的量浓度为=(a/M)÷(V×10-3)=![]() mol/L,故D正确;
mol/L,故D正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O![]() 6Cu+SO2↑,下列对于该反应的说法中,正确的是( )
6Cu+SO2↑,下列对于该反应的说法中,正确的是( )
A.该反应中的氧化剂只有Cu2OB.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物D.SO2既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成份均过量)。

(1)B装置的作用是______________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有__________气体产生,写出D中发生反应的离子方程式___________________________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;_____ | _________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为___________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为 。
(2)下列物质在一定条件下能跟丁子香酚反应的是 。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
① 与NaHCO3溶液反应
② 苯环上只有两个取代基
③ 苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO

A→B的化学方程式为_______________________,反应类型为______________________。C中滴加少量溴水振荡,主要现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A. N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B. 铂做电极,以KOH溶液为电解质的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
C. 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O![]() N2H5+ + OH-
N2H5+ + OH-
D. 2NO2![]() N2O4,加压时颜色加深,可以用勒夏特列原理解释
N2O4,加压时颜色加深,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)21世纪是钛的世界,钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:

I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为________________,制备时需要________,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________(填仪器名称)中加热。
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________,AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铝、镓、铟、铊是第ⅢA族元素,它们在工农业生产中应用非常广泛。
(1)基态硼原子的核外电子排布图为______________________。
(2)I1(Mg)___________I1(Al)(填“大于”或“小于”),其原因是______________________。
(3)三氯化铝加热到177.8℃时,会升华为气态二聚氯化铝(Al2Cl6,其中铝原子和氯原子均达8电子稳定结构),请写出二聚氯化铝(Al2Ci6)的结构式:______________________,其中铝原子轨道采用___________杂化。
(4)BF4-的空间构型为___________,与BF4-互为等电子体的分子是___________ (写化学式,任写一种即可)。
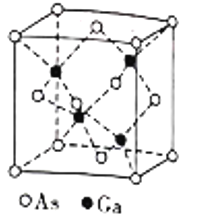
(5)镓(Ga)可与砷(As)形成砷化(GaAs)晶体,该晶体的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,阿伏加德罗常数值为NA,则晶胞中Ca与As原子的核间距为___________pm。(列出字母表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是应用广泛、性能较好的还原剂,以硼酸、甲醇和氢化钠(NaH)为原料可制得硼氢化钠。某学习小组的同学欲利用下图所示路线在实验室合成硼氢化钠。

I.氢化钠的制备
已知NaH的化学反应活性很高,在潮湿的空气中能自燃,与酸接触即放出热量和氢引发燃烧甚至爆炸。该小组的同学利用下图中的装置在实验室制取NaH。

(1)NaH中氢元素的化合价为___________,NaH的电子式为___________。
(2)按气流方向连接各仪器接口,顺序为a→___________b→c(填接口字母);连接装置后进行实验,在给装置B加热前,必须进行的一步操作是___________。
(3)装置A中盛装稀盐酸的仪器名称为___________,装置D中应盛装的试剂是___________。
(4)经分析,该实验装置有一个明显的不足是____________,解决此不足的措施是__________。
Ⅱ.硼氢化钠的制备与纯度测定
在搅拌加热到220℃时,向盛装NaH的缩合反应罐中加入硼酸三甲酯[B(OCH3)3],升温到260℃,充分反应后,经过处理得到NaBH4和甲醇钠。
(5)某同学欲通过测定硼氢化钠与水反应生成氢气的体积来测定硼氢化钠产品的纯度。
已知:NaH+H2O=H2↑+NaOH。
①硼氢化钠与水反应可以产生大量氢气和偏硼酸钠,该反应方程式为___________。
②该同学用图装置测定硼氢化钠产品的纯度(杂质只有氢化钠)。装置中a的作用是_________;称取6.28g氢化钠样品,重复实验操作三次,测得生成气体的平均体积为13.44L(已折算为标准状况),则样品中硼氢化钠的纯度为___________%(结果保留两位有效数字)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com