
【题目】下列诗句描述的过程中包含化学变化的是( )
A.零落成泥碾作尘B.爆竹声中一岁除
C.人面桃花相印红D.群山倒影山浮水
科目:高中化学 来源: 题型:
【题目】在 N2 +3H2 == 2NH3 的反应中,在5S中N2由6mol/L减至2mol/L。则N2的平均反应速率是
A. 4 mol/LB. 4mol/(L·S)C. 0.8 mol/LD. 0.8 mol/(L·S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
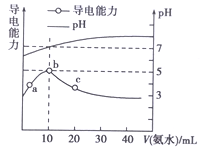
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480 mL 0.200 mol·L-1的Na2CO3溶液,现用Na2CO3固体配制,可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤漏斗 ⑥天平 ⑦药匙 ⑧500 mL容量瓶 ⑨250 mL容量瓶。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时必须使用的仪器除①③⑥⑦外,还有_____(填数字序号)。
(2)经计算,需Na2CO3固体的质量为________。
(3)在容量瓶中确定溶液体积的过程中,最后加入少量水的做法_________。
(4)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol·L-1。请你分析配制过程中可能引起该误差的原因是(填字母代号)________。
A.定容时俯视液面
B.转移时没有洗涤烧杯和玻璃棒
C.配制时容量瓶不干燥
D.称Na2CO3固体的质量时物码倒置
(5)将配好的溶液盛装于下列(填字母代号)_______仪器中,贴好标签备用。
A.带玻璃塞的广口瓶 B.带玻璃塞的细口瓶
C.带胶塞的广口瓶 D.带胶塞的细口瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠在无机制备、废水处理等领域常用作沉淀剂,其水溶液称为“臭碱”。可在特殊条件下以硫酸钠固体与炭粉为原料制备:Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑

(1)硫化钠固体在保存时需注意________,原因是________。
(2)实验室用上图装置以Na2SO4与炭粉为原料制备Na2S并检验气体产物、进行尾气处理。步骤如下:
①连接仪器顺序为________(按气流方向,用小写字母表示);
②检查装置气密性;③________;
④加热,进行实验。
(3)若 a mol Na2SO4和2 a mol C按上述步骤充分反应,实际得到Na2S小于amol,则实验改进方案是________。
某同学从氧化还原角度分析固体产物中可能含有少量Na2SO3,请设计实验证明其猜测是否合理(供选择的试剂有:酚酞溶液、硝酸、稀盐酸、蒸馏水) ________。
(4)经实验测定,硫酸钠与炭粉在一定条件下反应还可生成等物质的量的两种盐和体积比为1︰3的CO2和CO两种气体。反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组材料中,能组成原电池的是( )
A | B | C | D | |
两极材料 | Zn片、Cu片 | Cu片、 Cu片 | Zn片、Cu片 | Zn片、Cu片 |
插入溶液 | 稀H2SO4 | NaCl溶液 | 植物油 | 酒精 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素,霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1
2NO2(g) H=-113.0 kJ mol-1
Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1
2SO3(g) H=-196.6 kJ mol-1
二氧化硫通常在二氧化氮的存在下,进一步被氧化,生成三氧化硫。
①写出NO2和SO2反应的热化学方程式为______。
②反应Ⅱ自发进行的条件是______(填“较高温”“较低温”或“任何温度”)。
(2)提高2SO2(g)+O2(g) ![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______。
②在①中条件下,反应达到平衡后改变下列条件,能使SO2的转化率提高的是______(填字母)。
a.温度和容器体积不变,充入1.0mol He
b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(3)电解NO制备NH4NO3,其工作原理如图所示。阳极的电极反应式为_____________________________,为使电解产物全部转化为NH4NO3,需补充物质是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是

A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com