
【题目】在某温度时,将n mol/L氨水滴入10mL 1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,有关说法正确的是( )
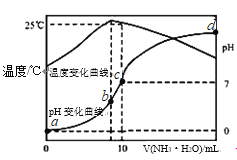
A. a点Kw=1.0×10﹣14 mol 2![]() L﹣2
L﹣2
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
D. 25℃ 时NH3·H2O的电离常数为![]() mol
mol![]() L-1(用n表示)
L-1(用n表示)
【答案】D
【解析】A. a点时,温度低于25℃,所以Kw<1.0×10﹣14 mol 2![]() L﹣2,故A错误;B. b点温度最高,此处中和反应恰好进行,形成氯化铵溶液,氯化铵水解促进水的电离,a点盐酸剩余,c、d点氨水过量,酸、碱抑制水的电离,且酸的c(H+)或碱的c(OH﹣)越大,对于水的电离的抑制程度越大,所以水的电离程度:b>c>d>a,故B错误;C. b点氯化铵水解:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),故C错误;D. 25℃ 时电荷守恒:c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),pH=7,c(OH﹣)= c(H+)=10-7 mol
L﹣2,故A错误;B. b点温度最高,此处中和反应恰好进行,形成氯化铵溶液,氯化铵水解促进水的电离,a点盐酸剩余,c、d点氨水过量,酸、碱抑制水的电离,且酸的c(H+)或碱的c(OH﹣)越大,对于水的电离的抑制程度越大,所以水的电离程度:b>c>d>a,故B错误;C. b点氯化铵水解:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),故C错误;D. 25℃ 时电荷守恒:c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),pH=7,c(OH﹣)= c(H+)=10-7 mol![]() L-1,c(Cl﹣)=c(NH4+)=0.5 mol
L-1,c(Cl﹣)=c(NH4+)=0.5 mol![]() L-1,c(NH3·H2O)=(n-1)/2mol
L-1,c(NH3·H2O)=(n-1)/2mol![]() L-1,NH3·H2O的电离常数为
L-1,NH3·H2O的电离常数为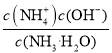 =
=![]() mol
mol![]() L-1,故D正确。故选D。
L-1,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向氧化铁、氧化铜、铁、铜的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100ml0.25molL﹣1 AlCl3溶液中,Cl﹣的物质的量浓度为molL﹣1;若将上述溶液加水稀释到500ml,Cl﹣的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
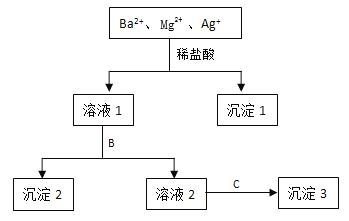
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
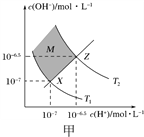
【题目】下列有关图示说法不正确的是( )
![]()
![]()
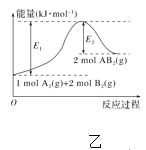
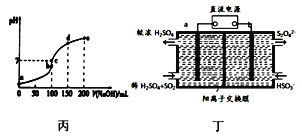
A. 图甲表示水中c(H+)和c(OH-)的关系,则XZ线上任意点均表示溶液呈中性
B. 图乙表示由2 mol A(g)和4 mol B(g)形成4 mol A—B键放出E2 kJ能量
C. 25℃时向l00mL0.1mol/L NH4HSO4溶液中滴加0.lmol/L NaOH溶液的pH与NaOH溶液体积关系曲线如图丙,则a点到b点过程中,溶液导电能力增强
D. 图丁装置(电极均为惰性电极)可吸收SO2,其阴极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是0.012kg 12C中含有的碳原子数目
D.标准状况下,1molH2O所占的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
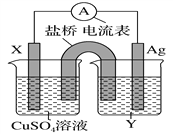
(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com