
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
(1)<(2)80%;不变(3)a(4)2.5
【解析】
试题分析:(1)通过平衡常数和温度的关系:平衡常数随温度增加而减少,根据勒夏特列原理,温度升高,平衡向吸热反应方向进行,因此 △H<0;
(2)设消耗A的物质的量为x
A(g) + B(g) 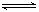 C(g)+D(g)
C(g)+D(g)
起始物质的量: 0.20 0.80 0 0
变化的物质的量:x x x x
平衡物质的量:0.20-x 0.80-x x x
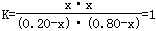 ,解得x=0.16,A的转化率=
,解得x=0.16,A的转化率= ×100%=80%
×100%=80%
等温等容下,充入非反应气体,各组分浓度不变,平衡不移动,A的转化率不变。
(3)a、单位时间内生成B和D的物质的量相等,说明生成B和D的速率相等,生成B和D的方向是一正一逆,能够作为达到化学平衡的标志;b、ρ=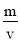 ,反应物和生成物都是气体,m不变,是等容的容器的v不变,因此反应的任何时刻ρ不变,不能作为达到化学平衡的标志;c、反应前后气体系数之和不变,压强在任何时刻不变,不能作为达到互学平衡的标志;d、M=
,反应物和生成物都是气体,m不变,是等容的容器的v不变,因此反应的任何时刻ρ不变,不能作为达到化学平衡的标志;c、反应前后气体系数之和不变,压强在任何时刻不变,不能作为达到互学平衡的标志;d、M=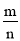 ,M反应任何时刻不变,不能作为达到化学平衡的标志。(4)1200 ℃时反应C(g)+D(g)
,M反应任何时刻不变,不能作为达到化学平衡的标志。(4)1200 ℃时反应C(g)+D(g) 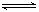 A(g)+B(g),
A(g)+B(g),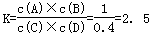 。
。
考点:考查化学平衡常数、判断达到化学平衡的标志。


科目:高中化学 来源:2014-2015安徽省淮南市高一上学期期末考试化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.庆祝节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入适量的铁粉
C.铁的氧化物种类较多,其中Fe3O4又称磁性氧化铁,常用作红色油漆和涂料
D.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
葡萄糖是人体内最重要的供能物质,在人体内发生的主要反应是
A.氧化反应 B.加成反应 C.取代反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列液体均处于25℃,有关叙述正确的是
A.某物质的水溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是
A.保持表面干燥 B.表面镀锌
C.表面镶嵌铜块 D.与电源负极相连
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
B.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
C.有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
D.酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:填空题
(8分)下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空:

(1)镀铜电路版制成印刷电路版的离子方程式为 ;固体1的化学成分是 (填化学式)。
(2)反应①的化学方程式为 ;要检验废液中是否含有Fe3+所需的试剂是 (填化学式)溶液。
(3)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
下列关于钠的叙述中,不正确的是
A.钠燃烧时发出黄色的火焰 B.钠燃烧时生成氧化钠
C.钠有很强的还原性 D.钠原子的最外层只有一个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(15分)近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 。用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com