
| A、溶液中SO42-的浓度是0.3 mol/L |
| B、溶液中一定含有A13+和NH4+ |
| C、一定不存在Mg2+,可能存在A13+ |
| D、一定存在Cl- 可能含CO32- |
| 0.58g |
| 58g/mol |
| 6.99 |
| 233 |
| 0.03mol |
| 0.1L |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
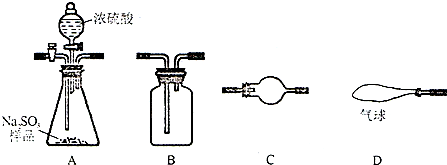
| 实验装置(填字母) | D | ||||||
| 装置中所盛药品(填序号) | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W、T是短周期表中的5种主族元素.X基态原子核外L层p电子数等于s电子数.Y的一种核素的质量数为19,中子数比质子数多1.T-离子核外电子数与氩原子的核外电子数相同.X、Y、Z、W的第一电离能与它们的核电荷数的关系如图所示.
X、Y、Z、W、T是短周期表中的5种主族元素.X基态原子核外L层p电子数等于s电子数.Y的一种核素的质量数为19,中子数比质子数多1.T-离子核外电子数与氩原子的核外电子数相同.X、Y、Z、W的第一电离能与它们的核电荷数的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
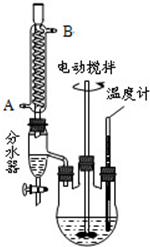
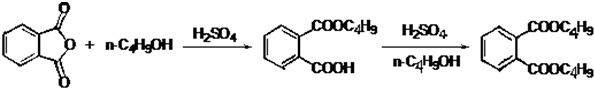
查看答案和解析>>
科目:高中化学 来源: 题型:
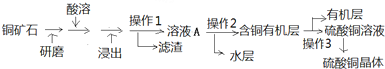
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.0001mol/L的HCl |
| B、0.00001mol/L的H2SO4 |
| C、0.0000001mol/L的NaOH |
| D、纯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
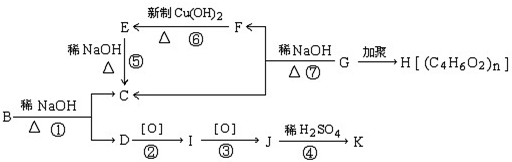
查看答案和解析>>
科目:高中化学 来源: 题型:
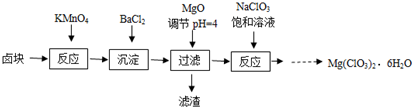
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期 |
| C原子所有轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
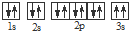 ,违背了
,违背了查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com