
����Ŀ����1����ͬ��ͬѹ�£�2gCO2�����Ϊ1120mL����2gA��������Ϊ770mL��������A��Ħ������Ϊ__________mol/L��
��2������A��B��C���ֻ������ȡ40g���ϣ���ȫ��Ӧ��B 18g��C49g������D���ɡ���֪D��ʽ��Ϊ106���ֽ�22gA��11gB��Ϸ�Ӧ��������D_____ mol��
��3����������李�NH4Al(SO4)2����Һ�еμ�Ba(OH)2��Һ�����ȣ��պ�ʹNH4+ȫ��ת��ΪNH3��д����Ӧ����������ʽ��________________________________________��
���𰸡� 64 0.25 NH4++Al3++2SO42��+2Ba2++4OH�� ![]() NH3��+Al��OH��3��+2BaSO4��+H2O
NH3��+Al��OH��3��+2BaSO4��+H2O
����������1�����ݰ���٤�����ɵ����ۣ�ͬ��ͬѹ�£�ͬ���������壬���ʵ���֮��=���֮��=Ħ�������ĵ����ȣ���M(A)��M(CO2)=V(CO2)��V(A)������M(A)= ![]() = 64g/mol��
= 64g/mol��
��2�������⣬40gA��ȫ��Ӧ����Ӧ��B������Ϊ40g-18g=22g�����ɵ�C������Ϊ49g-40g=9g�����������غ㶨�ɣ����ɵ�D������Ϊ40g+22g-9g=53g��11gB��ȫ��Ӧ��ҪA������Ϊ40g��![]() =20g����22gA��11gB��Ӧ��A��ʣ�࣬B��ȫ��Ӧ����������D������Ϊ53g��
=20g����22gA��11gB��Ӧ��A��ʣ�࣬B��ȫ��Ӧ����������D������Ϊ53g��![]() =26.5g�����ʵ���Ϊ��26.5g��106g/mol=0.25mol��
=26.5g�����ʵ���Ϊ��26.5g��106g/mol=0.25mol��
��3�����������[NH4Al(SO4)2]��Һ�еμ�Ba(OH)2��Һ�����ȣ�������Al(OH)3������������NH3H2O�����պ�ʹNH4+ȫ��ת��ΪNH3�����������[NH4Al(SO4)2]��Ba(OH)2Ӧ�����ʵ���֮��1��2��Ӧ�����ӷ���ʽΪ��NH4++Al3++2SO42-+2Ba2++4OH-![]() NH3��+Al(OH)3��+2BaSO4��+H2O��
NH3��+Al(OH)3��+2BaSO4��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. 18O��16O����������ͬ�����ֺ���
B. �����һ��ͬ���칹�������Ϊ2-�һ�����
C. �����һ�ȴ�����������һ�ȴ���������ͬ
D. ���ʯ��ʯī����������ȫȼ�վ�ֻ���ɶ�����̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����·������з�Ӧ��
��16H����10Z����2XO![]() ===2X2����5Z2��8H2O
===2X2����5Z2��8H2O
��2A2����B2===2A3����2B������2B����Z2===B2��2Z��
����������Ӧ���ж����н��۴������(����)
A. ��Һ�пɷ�����Z2��2A2��===2A3����2Z�� B. Z2�ڢ٢۷�Ӧ��Ϊ��ԭ��
C. ������ǿ����˳��Ϊ��XO![]() >Z2>B2>A3�� D. X2����XO
>Z2>B2>A3�� D. X2����XO![]() �Ļ�ԭ����
�Ļ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��������������ʵ����
A. ������������������θ����� B. �������ƿ�����DZˮͧ������
C. ����������������Ũ���� D. ��ȩ������ʳƷ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ɫ����PCl5���ȼ��ӷ��������ֽ⣺PCl5(g) ![]() PCl3(g)��Cl2(g)���ֽ�5.84 g PCl5װ��2.05 L����ܱ�����������277 ���ﵽƽ����������ѹǿΪ1.01��105 Pa���������֪ƽ��ʱ�����ڻ����������ʵ���Ϊ0.05 mol��ƽ��ʱPCl5�ķֽ���Ϊ________��
PCl3(g)��Cl2(g)���ֽ�5.84 g PCl5װ��2.05 L����ܱ�����������277 ���ﵽƽ����������ѹǿΪ1.01��105 Pa���������֪ƽ��ʱ�����ڻ����������ʵ���Ϊ0.05 mol��ƽ��ʱPCl5�ķֽ���Ϊ________��
��2������������Һ�еĻ�ԭ�Ժ�������ǿ��˳�����£���ԭ��HSO![]() >I����������IO
>I����������IO![]() >I2>SO
>I2>SO![]() ������x mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ����xΪ________mol��
������x mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ����xΪ________mol��

��3���״���ˮ�ʻ����һ������Ⱦ����ϸ���������£��ð���NH3���������״���CH3OH���Ĺ�ҵ��ˮ��ʹ��������CO2��N2���Ӷ������Ի�������Ⱦ����ѧ����ʽΪ��_____________________���ù����б�������Ԫ���� ___________����������״����2.24L![]() ʱ����ת�Ƶ���_______mol��
ʱ����ת�Ƶ���_______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ȼ�ѧ����ʽ��
H2(g)+l/2O2(g)=H2O(g) ��H=akJ/mol
H2(g)+l/2O2(g)=H2O(l) ��H=bkJ/mol
2H2(g)+O2(g)=2H2O(l) ��H=ckJ/mol
�������ǵ����б�����ȷ����
A. 2b=c B. a��b��c��Ϊ��ֵ C. a=b D. ���Ƕ������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ά���غ���Ԫ�ص���������ȷ����
A. ��������ά����C����ǿ�Դ�Ⱦ���ĵֿ��������������нⶾ����
B. ά����D���ڵ��͵�ˮ����ά����
C. Ϊ���������߲��е�ά����C����ʧ�����߲˵�ʱ�䲻��̫�������켴��
D. ����ά����D����������Ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�������Ԫ����ɵĻ�����A��������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ������֪��EΪ����ɫ���壬F��HΪ�������ʣ�JΪ��ɫ�ǽ������ʡ�L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ��B��F��Ӧʱ������C��Ҳ������G���Իش��������⣺

��1������K��������_________��I�ľ�������____________���塣
��2����֪A������Ԫ��ԭ�ӳ���������ȣ��ҽ���Ԫ����ǽ���Ԫ�ص�������Ϊ14��1����A�Ļ�ѧʽΪ���� �� ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ____________��
A��B��Ӧ�Ļ�ѧ����ʽ___________��
��4��H��D��ȼ�յ�����Ϊ____________��
��5����������Ӧ�������ǽ�����ȫ�ģ�������a mol����Lʱ����ҪA_________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2-��������������Ϳ����������Ӽ�����ʵ�����п�������ͼ��ʾװ���Ʊ�1��2-�������飮����A��F��װ���Ҵ���Ũ����Ļ��Һ��D�е��Թ���װ��Һ�壮���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѡ����г�װ������ȥ��
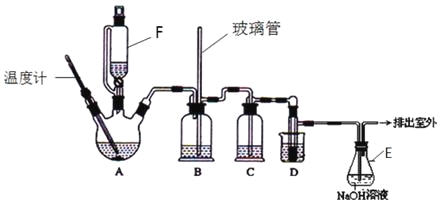
�й������б����£�
�Ҵ� | 1,2-�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶȣ�g�� cm-3 | 0.79 | 2.2 | 0.71 |
�е㣯�� | 78.5 | 132 | 34.6 |
�۵㣯�� | һl30 | 9 | -1l6 |
��д���пհף�
��1��A����Ҫ���������Ҵ�����ˮ��Ӧ������ȥ��Ӧ������д���Ҵ��������ȥ��Ӧ�Ļ�ѧ����ʽ�� ��
D�з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����ȫƿB���Է�ֹ�����������Լ��ʵ�����ʱ�����Ƿ�����������д����������ʱƿB�е����� ��
��3����װ��C��Ӧ���� ����Ŀ�������շ�Ӧ�п������ɵ��������壺������ȷѡ��ǰ����ĸ��
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��4������E��NaOH��Һ�������� ��
��5�������������������������ѣ�����________����������ƣ��ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com