
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)
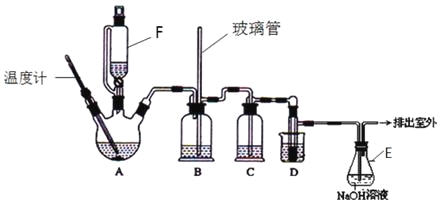
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
【答案】(1) CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
(2) b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3) C
(4)吸收挥发出来的溴,防止污染环境
(5) 蒸馏
(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞;
【解析】试题分析:(1) 乙醇发生消去反应生成乙烯和水,方程式为:CH3CH2OH![]() CH2=CH2↑+H2O,D中乙烯和溴发生加成反应生成1,2-二溴乙烷,方程式为:CH2=CH2+Br2→CH2BrCH2Br;(2)若装置中出现堵塞,则b中水面会下降,玻璃管中的水柱会上升,甚至溢出;(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫 ,二氧化碳、二氧化硫能和氢氧化钠溶液反应,所以在装置C中应加入氢氧化钠溶液,吸收反应中可能生成的酸性气体,所以选C;(4)氢氧化钠能和溴反应生成溴化钠和次溴酸钠和水,所以用氢氧化钠可以吸收挥发出来的溴,防止污染环境。(5)1,2-二溴乙烷沸点132℃,乙醚34.6℃,1,2-二溴乙烷与乙醚的沸点相差较大,两者均为有机物,互溶,用蒸馏的方法将它们分离;(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞。
CH2=CH2↑+H2O,D中乙烯和溴发生加成反应生成1,2-二溴乙烷,方程式为:CH2=CH2+Br2→CH2BrCH2Br;(2)若装置中出现堵塞,则b中水面会下降,玻璃管中的水柱会上升,甚至溢出;(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫 ,二氧化碳、二氧化硫能和氢氧化钠溶液反应,所以在装置C中应加入氢氧化钠溶液,吸收反应中可能生成的酸性气体,所以选C;(4)氢氧化钠能和溴反应生成溴化钠和次溴酸钠和水,所以用氢氧化钠可以吸收挥发出来的溴,防止污染环境。(5)1,2-二溴乙烷沸点132℃,乙醚34.6℃,1,2-二溴乙烷与乙醚的沸点相差较大,两者均为有机物,互溶,用蒸馏的方法将它们分离;(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞。


科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干、灼烧至质量不变,最终不能得到纯净物的是
A. 向漂白粉浊液中通入过量的CO2
B. 向带有氧化膜的铝片中加入盐酸
C. 向含有1molCa(HCO3)2的溶液中加入1molNa2O2
D. 向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某铁碳合金中铁的质量分数,某化学兴趣小组设计了图示实验装置。

(1)写出碳与浓硫酸反应的化学方程式_____________。
(2)C中品红溶液的作用_____________。
(3)该小组同学设计的实验装置存在缺陷,下列因素可能导致铁的质量分数测量值偏高的是_____________。
A. A中反应不完全
B. E 中碱石灰吸收空气中的CO2和H2O
C.反应生成的SO2部分被E 中碱石灰吸收
D.反应完全后,还有CO2气体滞留在装置体系中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO![]() ,反应的离子方程式为______________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
,反应的离子方程式为______________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
(2)“氧化”中欲使3 mol的VO2+变为VO![]() ,则需要氧化剂KClO3至少为________mol。
,则需要氧化剂KClO3至少为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物分子中,所有原子不可能处于同一平面的是( )
A. CH2=CH—CN B. CH2=CH—C(CH3)=CH2
C. ![]() D. CH2=CH—CH=CH2
D. CH2=CH—CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l:1.

答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1的是 (写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的水溶液呈现黄色,A、B、C、D之间有如图所示转化关系。

(1)A是________________(填写相关物质的化学式);
(2)C溶液与NaOH溶液混合后产生的现象____________________;
(3)①的反应类型:______(选填“化合”、“分解”、“置换”、“复分解”) ;
(4)某待测液中既有B中阳离子,又有C中阳离子。
检验待测液中有C中阳离子的方法:___________________________;
检验待测液中有B中阳离子的方法:__________________________;
(5)写出D![]() E的反应方程式:______________________。
E的反应方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制490 mL 0.5 mol L-1NaOH溶液以备使用。
(1)该同学应选择_____mL的容量瓶。
(2)应用托盘天平准确称量_______g NaOH固体。
(3)配制过程如图乙所示,则图甲操作应在图乙中的______ (填字母)之间。
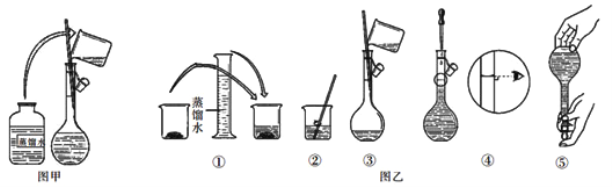
A.①与② B.②与③ C.③与④
(4)若在配制过程中出现下列情况,会使所配制NaOH溶液的浓度偏低的是______(填字母)。
A.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
B.定容时俯视
C.配制溶液所用的容量瓶洗净后没有烘干
D.NaOH固体在烧杯中溶解后,立即将溶液转移到容量瓶内,并接着进行后续操作
E.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com