
【题目】A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的水溶液呈现黄色,A、B、C、D之间有如图所示转化关系。

(1)A是________________(填写相关物质的化学式);
(2)C溶液与NaOH溶液混合后产生的现象____________________;
(3)①的反应类型:______(选填“化合”、“分解”、“置换”、“复分解”) ;
(4)某待测液中既有B中阳离子,又有C中阳离子。
检验待测液中有C中阳离子的方法:___________________________;
检验待测液中有B中阳离子的方法:__________________________;
(5)写出D![]() E的反应方程式:______________________。
E的反应方程式:______________________。
【答案】 Fe 产生红褐色沉淀 置换 取少量待测液,滴加KSCN溶液,溶液变血红色,说有待测液中有Fe3+ 取少量待测液,滴加高锰酸钾酸性溶液,紫色消失,说有待测液中有Fe2+ 4Fe(OH)2 +O2 +2H2O=4 Fe(OH)3
【解析】A是常见的金属,C的溶液呈现黄色,且C于KSCN溶液为血红色,结合转化关系可知,C为FeCl3,则A为Fe,B为FeCl2,D为Fe(OH)2 ,E为Fe(OH)3 ,
(1)A是Fe;(2)C为FeCl3溶液与NaOH溶液混合后产生的现象产生红褐色沉淀 ;(3)①Fe+2HCl=FeCl2+H2↑,反应类型:置换;(4)某待测液中既有B中阳离子Fe2+ ,又有C中阳离子Fe3+ 。检验待测液中有Fe3+ 中阳离子的方法:取少量待测液,滴加KSCN溶液,溶液变血红色,说有待测液中有Fe3+ ;检验待测液中有Fe2+ 中阳离子的方法:取少量待测液,滴加高锰酸钾酸性溶液,紫色消失,说有待测液中有Fe2+;(5)D![]() E的反应方程式:4Fe(OH)2 +O2 +2H2O=4 Fe(OH)3
E的反应方程式:4Fe(OH)2 +O2 +2H2O=4 Fe(OH)3


科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化,回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个____________,电子除空间运动状态外,还有一种运动状态叫做____________。
(2)硒常用作光敏材料,基态硒原子的价电子排布式为_______________;与硒同周期的p区元素中第一电离能大于硒的元素有_________种。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为___________,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式________________。SnCl4分子的空间构型为_______。

(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。

①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为_________。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为_______。(不必计算出结果,用NA表示阿伏伽德罗常数。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
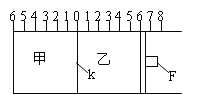
(1)可根据__________现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是____________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号:① <6 ② >6 ③ =6)
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为_________;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)
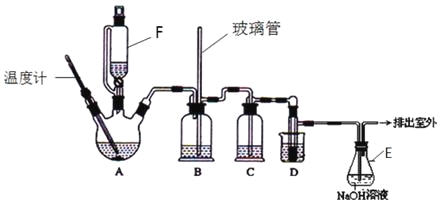
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL0.5mol·L- NaOH溶液以备使用。
(1)该同学应选择_______mL的容量瓶。
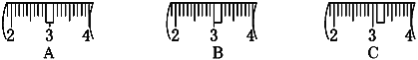
(2)该同学应称取NaOH固体_______g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______ (填字母),并在下图中选出能正确表示游码位置的选项_______(填字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(3)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或无影响,下同)
②容量瓶中原来有少量蒸馏水,浓度会_____。
(4)完成以下氧化还原反应的离子方程式:
______MnO![]() +______C2O
+______C2O![]() +______=_______Mn2++_______CO2↑+________。
+______=_______Mn2++_______CO2↑+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
B. 含有5个碳原子的某饱和链烃,其一氯取代物的结构可能有3种
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,得到的结构可能有6种
D. 菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述正确的是
A.标准状况下,2.24LCCl4中含有0.4NA个碳氯单键
B.22.4LCl2通入水中充分反应,共转移NA个电子
C.1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA
D.5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制1 mol/L稀硫酸100 mL,其操作有以下各步:
①用量筒量取一定体积的浓硫酸
②洗涤烧杯和玻璃棒2~3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2 cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取__________mL浓硫酸;应选择_________mL量筒(填5、10 或 50)。
(2)本实验用到的仪器己有烧杯、量筒、玻璃棒,还缺少的仪器是___________。
(3)正确的操作顺序是_________________(用序号填写)。
(4)下列操作会对所配溶液浓度产生什么影响(填“偏高”、“偏低”或“无影响”)
①转移浓硫酸后,小烧杯未洗涤:_______________;
②量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中:________________;
③定容时俯视容量瓶刻度线:________________;
④使用前容量瓶未干燥:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蛋白质分子由N条肽链组成,已知它共由M个氨基酸组成,则此蛋白质中至少含有的氧原子数有( )
A. 2M个 B. (M-N)个 C. M个 D. (M+N)个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com