
| A. | 在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 | |
| B. | 在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- | |
| C. | 在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 | |
| D. | 某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
分析 A.五水硫酸铜为蓝色,无水硫酸铜为白色,浓硫酸吸收结晶水;
B.白色沉淀可能为AgCl或硫酸钡;
C.Cu与稀硫酸不反应,氢离子的氧化性较弱;
D.品红溶液褪色,可知气体具有漂白性.
解答 解:A.五水硫酸铜为蓝色,无水硫酸铜为白色,浓硫酸吸收结晶水,则由现象可知浓硫酸具有吸水性,故A正确;
B.白色沉淀可能为AgCl或硫酸钡,则原未知试液中可能含有SO42-,或银离子,但二者不能同时存在,故B错误;
C.Cu与稀硫酸不反应,氢离子的氧化性较弱,结论不合理,稀硫酸具有弱氧化性,故C错误;
D.品红溶液褪色,可知气体具有漂白性,则气体为氯气、二氧化硫等,故D错误;
故选A.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质的性质、离子的检验、现象与反应的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
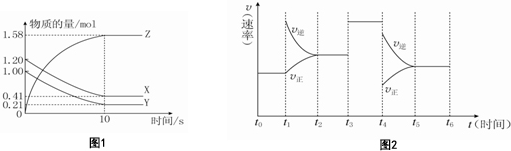
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
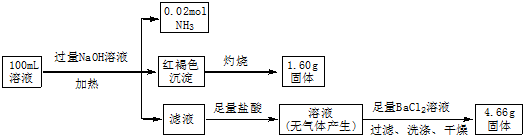
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
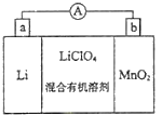 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
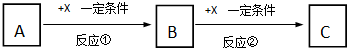
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com