
已知:2CO(g)+O2(g)====2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)====Na2CO3(s)+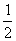 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
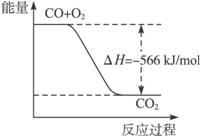
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)====2Na2CO3(s)+O2(g) H>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
若以w1和w2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列 判断正确的是(氨水的密度比纯水的小)
A.2w1=w2 B.2w2=w1 C.w2>2w1 D.w1<w2<2w1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分烯烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b k J,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) △H=-4b k J/mol
B.C2H2(g)+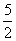 O2(g) ===2CO2(g)+H2O(l) △H=2b k J/mol
O2(g) ===2CO2(g)+H2O(l) △H=2b k J/mol
C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) △H=-2b k J/mol
D.2C2H2(g)+5O2(g)=== 4CO2(g)+2H2O(l) △H=b k J/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )

A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA
B.28 g CO中所含的原子数为2 NA
C.0.1 mol·L-1 Na2CO3溶液中,含有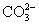 数为0.1 NA
数为0.1 NA
D.标准状况下,22.4 L苯的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是
A.溶液中可能含有AlO2-
B.溶液中可能含有NO3-
C.溶液中一定不含Fe2+和Fe3+
D.溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
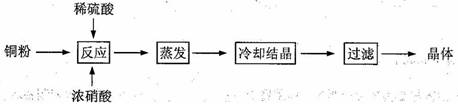
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、
。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.0 15 g,而实验测定结果是l.000 g 测定的相对误差为 。
15 g,而实验测定结果是l.000 g 测定的相对误差为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验不能达到目的的是( )
A.往酸性KMnO4溶液中通入乙烯验证乙烯的还原性
B.加热氯化铵与氢氧化钙固体混合物制取氨
C.用二氧化锰与稀盐酸反应制取氯气
D.用四氯化碳萃取碘水中的碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com