
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示,下列说法正确的是
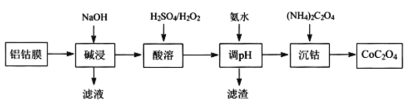
A.酸溶时H2O2做氧化剂,且温度不宜过高
B.加氨水调pH的目的是除铝
C.沉钴的离子方程式为:Co2++C2O42-=CoC2O4↓
D.在空气中加热4.41gCoC2O4得到钴的氧化物2.41g,则该氧化物的化学式为Co3O4
【答案】CD
【解析】
A. “酸溶”时加入H2O2的目的是将+3价的钴还原为+2价,H2O2是还原剂,为防止H2O2分解温度不宜过高,故A错误;
B. 加氨水调节pH的目的是将Li+转变为LiOH沉淀而除去,故B错误;
C. “沉钴”时,CoSO4溶液和(NH4)2C2O4反应生成CoC2O4沉淀和(NH4)2 SO4,离子方程式为:Co2++C2O42-=CoC2O4↓,故C正确;
D. 煅烧4.41g (0.03mol)CoC2O4生成钴氧化物,测得充分煅烧后固体质量为2.41g,根据Co守恒,钴元素的物质的量为0.03mol,质量为0.03mol×59g/mol=1.77g,氧元素的质量为2.41g1.77g=0.64g,其物质的量为0.04mol,据此可知化学式为Co3O4,故D正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 分子中含有
分子中含有![]()
![]() 个碳氧双键
个碳氧双键
B.一定温度下,![]() 完全反应转移的电子数一定为
完全反应转移的电子数一定为![]()
![]()
C.常温常压下,![]() 固体中离子总数为
固体中离子总数为![]()
![]()
D.常温常压下,![]() 溶液中
溶液中![]() 和
和![]() 数目之和为
数目之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
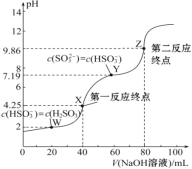
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等容积的两容器内分别充满![]() 和
和![]() 气体。下列说法正确的是
气体。下列说法正确的是
A.所含分子数和质量均不相同
B.含有相同的分子数和电子数
C.含有相同的质子数和中子数
D.含有相同数目的中子、原子和分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
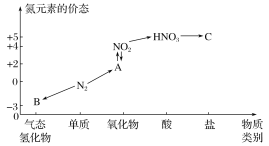
(1)写出N2的两种用途:_________、____。常用作制冷剂的化合物是________(名称)。该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_________。
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为_______。
(3)NO2与水反应生成物质A的离子方程式为______________。
(4)浓硝酸与木炭在加热条件下反应的化学方程式为___________________。
(5)氨水显碱性,写出氨水的电离方程式______________________________;
(6)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 加水稀释可以使溶液由c点变到d点
B. 此温度时,Ksp(BaSO4)=1.1×10-10
C. b点有BaSO4沉淀析出
D. a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是![]() /
/![]() 燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是
燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A. 电池总反应为:![]()
B. 电池放电过程中,![]() 从B极区向A极区移动
从B极区向A极区移动
C. 电池放电过程中,B极区pH减小,A极区pH增大
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的A极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,A、B、C三种气体的物质的量随时间的变化曲线如图所示。由图中数据分析
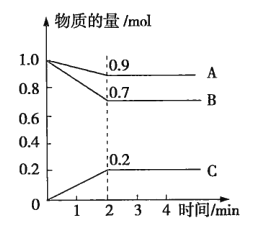
(1)该反应的反应物是_______。
(2)该反应_______(填“是”或“不是”)可逆反应,原因是______________。写出该反应的化学方程式:_______。
(3)反应开始至2min时,用C表示的平均反应速率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com