
【题目】下列指定微粒数目一定相等的是( )
A.等质量的15N2与12C16O中的分子数
B.等质量的C2H4与C3H6中含有的碳原子数
C.等体积、等浓度的NH4Cl与(NH4)2SO4溶液中的NH![]() 数
数
D.等质量的Fe与Cu分别与足量Cl2反应时转移的电子数
【答案】B
【解析】
A.15N2与12C16O的摩尔质量分别是30g/mol、28g/mol,质量相同时,物质的量不同,所以分子数也不相同,A不符合题意;
B.C2H4与C3H6的最简式都是CH2,等质量时,物质的量相同,所含碳原子数相同,B符合题意;
C.等体积、等浓度时含有相同物质的量的NH4Cl与(NH4)2SO4,电离方程式为NH4Cl=![]() +Cl-,(NH4)2SO4=2
+Cl-,(NH4)2SO4=2![]() +
+![]() ,如果忽略水解差异,铵根离子数目后者是前者的2倍,C不符合题意;
,如果忽略水解差异,铵根离子数目后者是前者的2倍,C不符合题意;
D.Fe、Cu与足量Cl2反应的产物分别是FeCl3、CuCl2,等质量(mg)铁转移的电子数是:![]() ,铜转移的电子数是
,铜转移的电子数是![]() ,二者不相等,D不符合题意;
,二者不相等,D不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是__。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留两位小数)。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____。
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
⑤如图是某次滴定时的滴定管中的液面,其读数为__________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
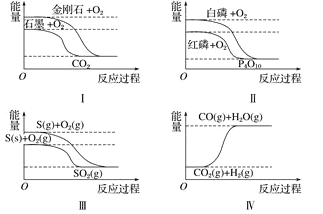
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化合物.其中乙烯是最简单的一种烯烃,其产量代表着一个国家石油化工产业的水平。
完成下列问题:
(1)实验室用如图所示装置制取乙烯,反应方程式是____,无水乙醇与浓硫酸的体积比为1:3,请解释加入浓硫酸不宜过少的原因是__。

(2)反应需要迅速升温至所需温度的理由是___。所以烧瓶中应放入的固体物质是___,其作用是____。
(3)烯烃通过催化加氢可以得到烷烃。请写出一种可以通过催化加氢反应得到2,2-二甲基丁烷的结构简式:___。
(4)有一种烷烃A,分子式C9H20,它却不能由任何C9H18的烯烃催化加氢得到。请写出A的结构简式___,在A的同分异构体中,却存在只能由1种烯烃催化加氢得到的烷烃,请写出一种符合要求的A的同分异构体的结构简式:___。
烯烃还可以与卤素单质、卤化氢、水发生加成反应,产物有主次之分,例如:


(5)化学式为C4H8的某烃A与HBr加成得到的主要产物,其一氯代物只有一种,请写出A发生聚合反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医药是中华民族的瑰宝,厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是( )
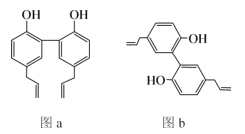
A.厚朴酚与溴可发生加成反应或取代反应
B.图b所示为厚朴酚的一种同分异构体
C.厚朴酚分子中所有碳原子可能共平面
D.1mol厚朴酚最多可跟8molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积的下列气体:①NO2,②HC1,③NH3。现将3支试管均倒置于水槽中,充分溶解后,所得溶液的物质的量浓度大小关系正确的是
A.①>②>③B.①=②=③C.②=③>①D.③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com