
| A、0.2mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.5 mol?L-1 |
| n |
| V |
| 0.06mol |
| 0.15L |


科目:高中化学 来源: 题型:
| A、氢氧燃料电池在熔融氧化物电解质中的正极反应式为:O2+4e-=2O2- |
| B、用铜电极电解饱和食盐水时,阳极的电极反应式为:2C1--2e-=C12↑ |
| C、铁制品镀锌时,要用锌作阴极,电极反应式为:Zn-2e-=Zn2+ |
| D、银在水膜酸性较强的溶液中将会发生析氢腐蚀,正极反应式为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、HCl是氧化剂 |
| B、Cl元素被还原 |
| C、MnO2在反应中失去电子 |
| D、生成1 mol Cl2时有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:

14 6 |
| A、②③④⑥⑦⑧ | B、①③④⑥⑦ |
| C、②⑥⑦⑧ | D、②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
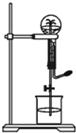 喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?
喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1mol CO2含有的氧原子数为2NA |
| B、0.1mol/L的Al2(SO4)3溶液中含SO42-数为0.3NA |
| C、标况下9g水所含分子数为0.5NA |
| D、常温下,2g氦气所含有原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O |
| B、铜粉投入到硝酸银溶液中:Cu+Ag+═Cu2++Ag |
| C、AlCl3溶液中加入少量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
| D、钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 5 |
| A、1.4mol/L |
| B、2.5mol/L |
| C、无法计算 |
| D、5.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com