
| 1 |
| 5 |
| A、1.4mol/L |
| B、2.5mol/L |
| C、无法计算 |
| D、5.0mol/L |
| 2.24L |
| 22.4L/mol |
| 1 |
| 5 |
| 2.24L |
| 22.4L/mol |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.2mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学不再需要实验 |
| B、化学研究只需要计算机模拟就行了 |
| C、化学不再是纯实验科学 |
| D、未来化学的方向还是经验化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
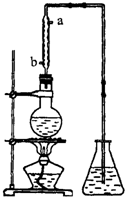 久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:
久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
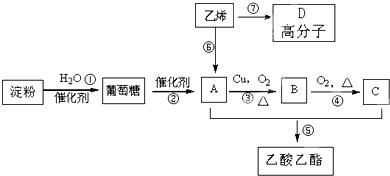
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
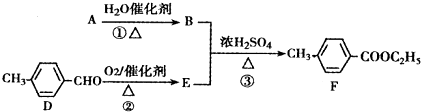
查看答案和解析>>
科目:高中化学 来源: 题型:
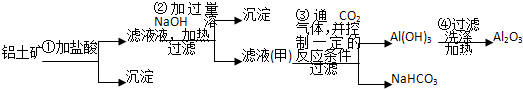
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com