
【题目】在标准状况下,测得1.92 g RO2某气体的体积为672 mL。
(1)该气体含分子的物质的量为__________。
(2)此气体的相对分子质量为__________。
(3)R的相对原子质量为__________。
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题21图。下列有关说法正确的是

A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫西沙星主要用于治疗呼吸道感染,物质L为合成莫西沙星的中间体,其合成路线如下:

已知:同一个碳原子上连有两个羟基不稳定,易脱水形成![]()
(1)A的化学名称为______,B中的官能团名称是______。
(2)E分子中共平面原子数目最多为________。
(3)物质G的分子式为C6H7N,其分子的核磁共振氢谱中有______个吸收峰。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。写出L的结构简式,用星号(*)标出L中的手性碳原子______________________。
(5)已知1 mol 物质J 与足量NaHCO3溶液反应生成2 mol CO2,写出D+J→K的化学方程式_________________________________________________。
(6)X是将H分子结构中的-CHO换为-NH2的同分异构体,且X苯环上有四个取代基, 则满足上述条件的X有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea)kJ/mol
B.反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
C.0.1 molL-1 CH3COOH溶液加水稀释,溶液中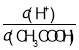 增大
增大
D.电解精炼铜时,粗铜与外接电源正极相连,电解过程中电解质溶液中的c(Cu2+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是( )
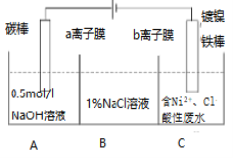
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.铁棒上发生的电极反应:2H++2e-===H2↑
B.电解过程中,B中NaCl溶液的质量分数将不断增大
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.若将图中a离子膜去掉,将A、B两室合并,则电解反应总方程式将不发生改变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com