
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是( )
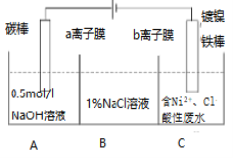
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.铁棒上发生的电极反应:2H++2e-===H2↑
B.电解过程中,B中NaCl溶液的质量分数将不断增大
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.若将图中a离子膜去掉,将A、B两室合并,则电解反应总方程式将不发生改变。
【答案】B
【解析】
镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大。
A.Fe棒为阴极,表面发生还原反应,则电极反应式为Ni2++2e-=Ni,故A错误;
B.镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的质量分数不断增大,故B正确;
C.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,故C错误;
D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl--2e-=Cl2↑,电解反应总方程式会发生改变,故D错误;
故答案为B。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,测得1.92 g RO2某气体的体积为672 mL。
(1)该气体含分子的物质的量为__________。
(2)此气体的相对分子质量为__________。
(3)R的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应![]() 的ΔH为____________________。
的ΔH为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
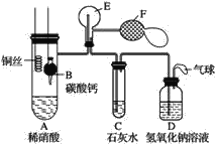
实验操作及现象为:
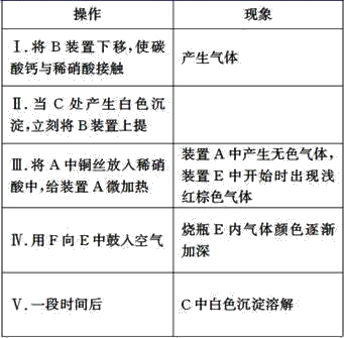
(1)操作Ⅰ中产生气体的离子反应方程式为__;
(2)操作Ⅰ的目的是__;
(3)C中白色沉淀的化学式是__,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__;
(5)烧瓶E内气体颜色逐渐加深的原因是__;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__;
(7)D装置的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
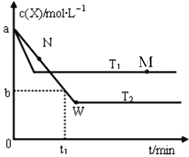
A. M点的 v正小于N点的v逆
B. M点时,升高温度平衡逆向移动
C. T2下,在0-t1时间内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W点时再加入一定量Y,平衡后Y的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH
(1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=______(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=_____________。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为______。
②下列说法正确的是______。
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com