
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH
(1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=______(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=_____________。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为______。
②下列说法正确的是______。
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率
【答案】ΔH1-3ΔH2 ![]() 60% B
60% B
【解析】
(1)依据热化学方程式 和盖斯定律计算分析判断;
(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H,依据平衡常数概念写出表达式;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②根据平衡状态的特征,分析解答。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1
②C(石墨)+CO2(g)=2CO(g) △H2
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H=△H1-3△H2,
故答案为:△H1-3△H2;
(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g),平衡常数K=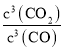 ;
;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=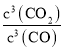 =
=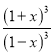 =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
故答案为:60%;
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H= -28.5kJmol-1
A.若容器压强始终恒定,不能标志反应达到平衡状态,A项错误;
B.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,B项正确;
C.乙容器中结合平衡常数计算得到消耗一氧化碳1mol,乙容器中CO的平衡转化率为66.6%,C项错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,D项错误;
故答案为:B。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是( )
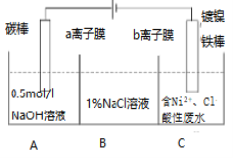
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.铁棒上发生的电极反应:2H++2e-===H2↑
B.电解过程中,B中NaCl溶液的质量分数将不断增大
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.若将图中a离子膜去掉,将A、B两室合并,则电解反应总方程式将不发生改变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:

(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾配制1L0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水里
B.称取胆矾25g,溶解在1L水里
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及图1所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。

(1)装置乙的作用是______________________________________。为防止污染空气,尾气中含有的______________需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________________、洗涤、灼烧。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究。取加热了t1min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌,随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示,则曲线c对应的溶液中的离子是______________________(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是__________。
(4)若取10.5 g NaHCO3固体,加热了t1min后,剩余固体的质量为7.4 g。如果把此剩余固体全部加入到200 mL 1 mol·L-1的盐酸中,则充分反应后溶液中H+的物质的量浓度为__________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮水安全在灾后重建中具有极其重要的地位,某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质、一处含有E物质,A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B__,D__。
(2)将含1molA的溶液与含1molE的溶液充分反应,仅得到一种化合物,该化合物为__。(填化学式)
(3)写出实验②发生反应的离子方程式__。
(4)C常用作净水剂,用离子方程式表示其净水原理__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向NaHSO3溶液中滴加足量Ba(OH)2溶液,出现白色沉淀,再加入足量盐酸,沉淀全部溶解 | NaHSO3未被氧化 |
B | 向3mLFe(NO3)3溶液中滴加几滴HI溶液,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | I-的还原性比Fe2+的强 |
C | 向MgSO4、CuSO4的混合稀溶液中滴入1滴稀NaOH溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 用精密pH试纸测得:浓度均为0.1mol·L-1的NH4HCO3溶液、HCOONa溶液的pH分别为7.8、10.0 | H2CO3电离出H+的能力比HCOOH的强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
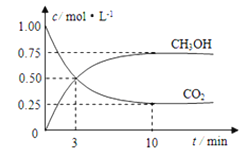
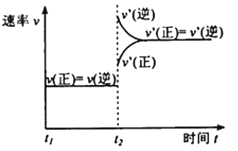
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________________。下图是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____________反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为______(保留两位小数),若提高温度到800℃进行,达平衡时,K值______(填“增大”、“减小”或“不变”)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______v(逆)(填“>”、“<”或“=”)。
(4)下列措施能使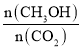 增大的是______。
增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com