
【题目】某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
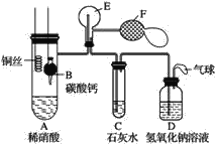
实验操作及现象为:
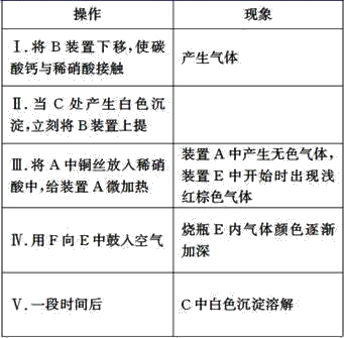
(1)操作Ⅰ中产生气体的离子反应方程式为__;
(2)操作Ⅰ的目的是__;
(3)C中白色沉淀的化学式是__,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__;
(5)烧瓶E内气体颜色逐渐加深的原因是__;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__;
(7)D装置的作用是__。
【答案】CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑ 用碳酸钙与稀硝酸反应产生的二氧化碳气体赶走装置内的空气 CaCO3 防止消耗硝酸过多影响铜与硝酸的反应 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O CO2比空气密度大,从长管进入E,没有把E中空气赶净,使部分NO先与空气生成少量红棕色二氧化氮气体,当再从F鼓入空气时,E中又生成二氧化氮气体,红棕色加深 C中白色沉淀溶解是因为氮氧化物和空气一起通过溶液会生成硝酸,4NO+3O2+2H2O=4HNO3,4NO2+O2+2H2O=4HNO3,硝酸能溶解碳酸钙沉淀 平衡压强,吸收氮氧化物、二氧化碳等尾气,防止污染空气
【解析】
该实验的原理是首先用碳酸钙与稀硝酸反应产生的CO2将装置中的空气排尽,以防止空气中的氧气对实验造成干扰,然后铜与稀硝酸反应产生气体,通过向E装置中通入空气,气体颜色变深,说明铜与稀硝酸反应产生的气体为NO,最后处理尾气。
(1)碳酸钙和硝酸反应生成二氧化碳赶净装置中的空气;
(2)操作Ⅰ的目的是用碳酸钙与稀硝酸反应产生的二氧化碳气体赶走装置内的空气;
(3)C中出现白色沉淀说明E中空气赶净,生成的沉淀为碳酸钙,C中白色沉淀的化学式是CaCO3,将B上提的原因是减少硝酸消耗量;
(4)铜和稀硝酸加热反应生成硝酸铜,一氧化氮和水,该化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(5)二氧化碳比空气密度大,未赶净E中的空气,生成的一氧化氮气体遇到空气中的氧气会生成二氧化氮红棕色气体,F鼓入空气更多的一氧化氮和氧气反应生成二氧化氮气体;
(6)操作Ⅴ现象产生的原因是,C中白色沉淀溶解是因为氮氧化物和空气一起通过溶液会生成硝酸,4NO+3O2+2H2O=4HNO3,4NO2+O2+2H2O=4HNO3,硝酸能溶解碳酸钙沉淀。
(7)D装置中的气球可以平衡压强,吸收氮氧化物、二氧化碳,防止污染空气。


科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫西沙星主要用于治疗呼吸道感染,物质L为合成莫西沙星的中间体,其合成路线如下:

已知:同一个碳原子上连有两个羟基不稳定,易脱水形成![]()
(1)A的化学名称为______,B中的官能团名称是______。
(2)E分子中共平面原子数目最多为________。
(3)物质G的分子式为C6H7N,其分子的核磁共振氢谱中有______个吸收峰。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。写出L的结构简式,用星号(*)标出L中的手性碳原子______________________。
(5)已知1 mol 物质J 与足量NaHCO3溶液反应生成2 mol CO2,写出D+J→K的化学方程式_________________________________________________。
(6)X是将H分子结构中的-CHO换为-NH2的同分异构体,且X苯环上有四个取代基, 则满足上述条件的X有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea)kJ/mol
B.反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
C.0.1 molL-1 CH3COOH溶液加水稀释,溶液中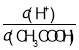 增大
增大
D.电解精炼铜时,粗铜与外接电源正极相连,电解过程中电解质溶液中的c(Cu2+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+![]() ═CaCO3↓+H2O
═CaCO3↓+H2O
B.向FeBr2溶液中通入足量的氯气: 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
C.向NaAlO2溶液中滴加少量NaHCO3溶液: ![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
D.用铁电极电解饱和食盐水 2Cl-+2H2O == 2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是( )
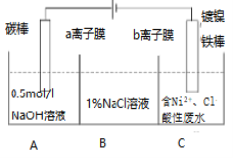
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.铁棒上发生的电极反应:2H++2e-===H2↑
B.电解过程中,B中NaCl溶液的质量分数将不断增大
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.若将图中a离子膜去掉,将A、B两室合并,则电解反应总方程式将不发生改变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A为新型高效的甲烷燃料电池,采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料、电解质溶液见图。

(1)甲烷燃料电池正极、负极的电极反应式分别为____;____。
(2)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为___极,通电一段时间后,观察到滤纸c端出现的现象是_____。
(3)已知C装置中溶液为AgNO3溶液,D装置的溶液为Cu(NO3)2溶液,打开K1,关闭K2,通电一段时间后,D装置中Cu极的电极反应式为____,C装置中总反应的离子方程式为___。
(4)若C装置中AgNO3溶液足量,且溶液体积为1L,电解一段时间后,C装置中产生O2的体积为0.56 L(标准状况下),则电路通过的电子的物质的量为___,溶液的pH为___(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了进行氨的催化氧化实验:4NH3+5O2![]() 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
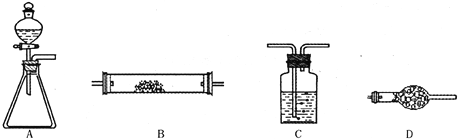
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) | 加入的试剂 | 作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾配制1L0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水里
B.称取胆矾25g,溶解在1L水里
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com