
【题目】为了进行氨的催化氧化实验:4NH3+5O2![]() 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
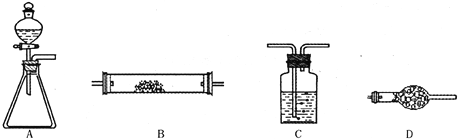
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) | 加入的试剂 | 作用 |
【答案】
选用的仪器(填字母) | 加入的试剂 | 作用 |
A | 分液漏斗:浓氨水 | 提供反应物 |
D | 碱石灰 | 干燥混合气体 |
B | 铂粉 | 反应的催化剂 |
C(D) | 氢氧化钠溶液(碱石灰) | 吸收氮的氧化物,防止污染空气(或其他合理叙述) |
【解析】
根据氨的催化氧化原理:4NH3+5O2![]() 4NO+6H2O。原料必须要提供氧气和氨气,原料中能提供氧气和氨气的应该是浓氨水和过氧化钠反应,仪器是装置A;
4NO+6H2O。原料必须要提供氧气和氨气,原料中能提供氧气和氨气的应该是浓氨水和过氧化钠反应,仪器是装置A;
出来后的气体因为有水蒸气,必须用干燥剂除去,但是因为有氨气,不能选用浓硫酸,只能用碱石灰,选择装置D;
在B中进行氨的催化氧化,用到催化剂铂粉;产生的氮氧化物要用氢氧化钠溶液吸收,选择装置C,
如果用碱石灰,则选择装置D。


科目:高中化学 来源: 题型:
【题目】某化工厂分析人员从车间取过氧化氢样品1.00mL 于锥形瓶中,加25mL 水稀释,再用硫酸酸化后,逐滴加入0.1000mol·L-1KMnO4 溶液。当反应完全时,消耗KMnO4溶液20.20mL。试计算该过氧化氢样品的物质的量浓度_____________。(2KMnO4 + 3H2SO4 + 5H2O2 == K2SO4 + 2MnSO4 + 5O2↑ + 8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
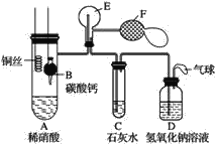
【题目】某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
实验操作及现象为:
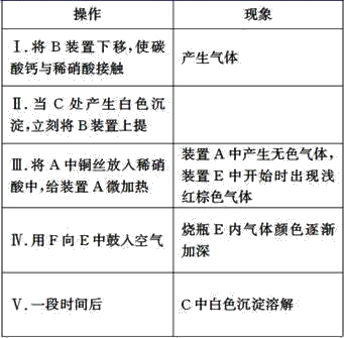
(1)操作Ⅰ中产生气体的离子反应方程式为__;
(2)操作Ⅰ的目的是__;
(3)C中白色沉淀的化学式是__,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__;
(5)烧瓶E内气体颜色逐渐加深的原因是__;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__;
(7)D装置的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
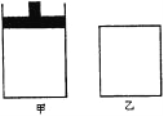
A. SO3体积分数:甲 > 乙
B. 平衡常数:甲>乙
C. 反应放出的热量:甲<乙
D. 保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
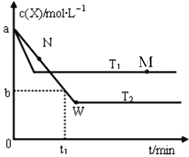
A. M点的 v正小于N点的v逆
B. M点时,升高温度平衡逆向移动
C. T2下,在0-t1时间内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W点时再加入一定量Y,平衡后Y的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
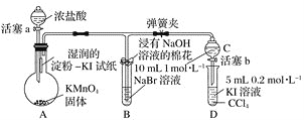
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
①标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
②常温常压下,18gH2O中含有的原子总数为3NA
③标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA
④常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
⑤100ml1mol/LFeCl3溶液中所含Fe3+的数目为0.1NA
⑥1LpH=1的硫酸溶液中含有H+的数目为0.1NA
A.①②④B.①②④⑤⑥C.②⑥D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁的基本生产流程如图所示,请回答下列问题。
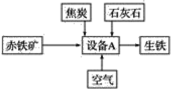
(1)写出设备A的名称:___________________________________________________。
(2)写出以赤铁矿为原料在高温下制取铁的化学方程式:__________________________。
(3)炼铁时焦炭的作用:
①________________________________________________________________________;
②________________________________________________________________________。
(4)石灰石的主要作用是造渣,造渣过程中涉及的主要反应有CaCO3![]() CaO+CO2↑、__________(写化学方程式)。
CaO+CO2↑、__________(写化学方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com