
【题目】下列反应的离子方程式书写不正确的是( )
A.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+![]() ═CaCO3↓+H2O
═CaCO3↓+H2O
B.向FeBr2溶液中通入足量的氯气: 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
C.向NaAlO2溶液中滴加少量NaHCO3溶液: ![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
D.用铁电极电解饱和食盐水 2Cl-+2H2O == 2OH-+H2↑+Cl2↑
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。该催化过程如图所示,下列有关说法不正确的是( )
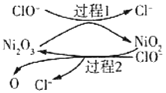
A.当溶液中c(ClO-)相同时,用Ca(ClO)2脱硫效果比用NaClO好
B.过程2中产生的原子氧可加快对SO2的吸收
C.过程2的离子方程式为2NiO2+ClO-=Ni2O3+Cl-+2O
D.H2SO3的酸性比HClO强,所以SO2能与NaClO溶液反应生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )
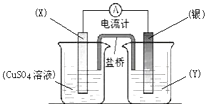
A. 电极X的材料是铜
B. 电解质溶液Y是硝酸银溶液
C. 银电极为电池的正极,发生的电极反应为:Ag++e﹣═Ag
D. 盐桥中的阳离子向硫酸铜溶液中移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
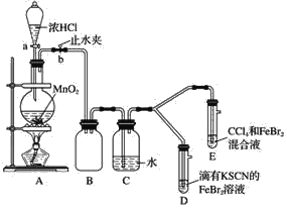
(1)①装置A中发生反应的离子方程式是______________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
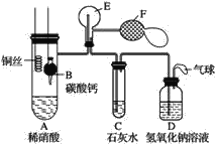
实验操作及现象为:
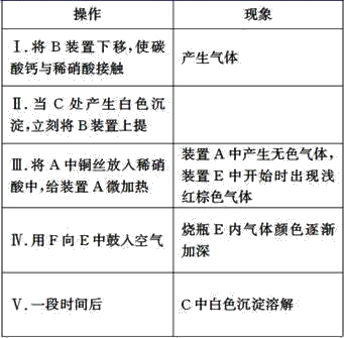
(1)操作Ⅰ中产生气体的离子反应方程式为__;
(2)操作Ⅰ的目的是__;
(3)C中白色沉淀的化学式是__,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__;
(5)烧瓶E内气体颜色逐渐加深的原因是__;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__;
(7)D装置的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素在化学中具有重要地位,请回答下列问题:
(1)下图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
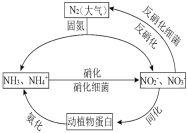
①N在元素周期表中的位置_________,![]() 的立体构型__________。
的立体构型__________。
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子,被氧化为两种常见离子。请将该反应的离子方程式补充完整:__CH3OH+__![]()
![]() ___+___+___+___ 。
___+___+___+___ 。
(2)砷及其化合物有重要的用途。
③砷(As)简化的电子排布式___,AsH3的熔沸点比NH3的 ___(填“高”或“低”),原因是____。
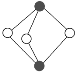
④雌黄(As2S3)在我国古代常用作书写涂改修正液。分子结构如下图,则砷原子的杂化方式为_____。
⑤砷化镓(GaAs)的熔点为1238℃,密度为ρ g·cm-3,其晶胞结构如图所示。
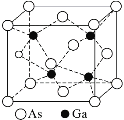
距Ga原子最近且等距的As原子个数为____,GaAs的摩尔质量为M g·mol-1,阿伏加德罗常数值为NA,则该晶胞边长为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
A. SO3体积分数:甲 > 乙
B. 平衡常数:甲>乙
C. 反应放出的热量:甲<乙
D. 保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,向密闭容器中充入2体积A和1体积B,发生如下反应:2A(g)+B(g) ![]() 2C(g),平衡时,混合气体体积比起始时减少了20%。若开始时充入4体积C,则达到平衡时C的转化率
2C(g),平衡时,混合气体体积比起始时减少了20%。若开始时充入4体积C,则达到平衡时C的转化率
A.50%B.40%C.30%D.20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com