
【题目】下列各组内的离子,在溶液中不能大量共存的是 ( )
A. Mg2+ K+ NO3- Cl- B. K+ Na+ Mg2+ SO42-
C. H+ SO42- Ba2+ NO3- D. Ca2+ H+ NO3- Cl-
科目:高中化学 来源: 题型:
【题目】U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如图1;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
(1)元素Z在周期表中位于第族.我国首创以W组成的金属﹣海水﹣空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流.只要把灯放入海水中数分钟,就会发出耀眼的白光.则该电源负极反应为 .
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为 , 由此可知YO2和VO还原性较强的是(写化学式) .
(3)V的最简单气态氢化物甲的水溶液显碱性.①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV 的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在图2坐标系中画出n(Fe2+)随n(Fe)变化的示意图 .
(4)相同温度下,等体积、物质的量浓度都为0.1mol/L的KZ和CH3COOK溶液的两种溶液中,离子总数相比较 .
A.前者多
B.一样多
C.后者多
D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.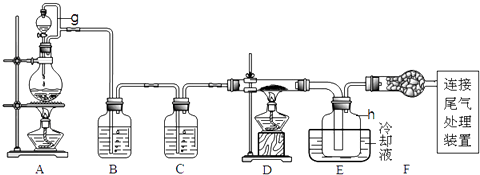
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 .
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是 .
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+ . ①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是 .
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10﹣2molL﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 . 若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2═6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为(用离子方程表示)
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+ , 并有气体逸出,请写出相应的离子方程式:
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL5molL﹣1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+ , 则参加反应的铁粉的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.35 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸溶于水使溶液的温度升高,是由于( )
A.浓硫酸溶于水,只发生扩散过程
B.浓硫酸溶于水,只发生水合过程
C.浓硫酸溶于水,扩散过程吸收的热量大于水合过程放出的热量
D.浓硫酸溶于水,扩散过程吸收的热量小于水合过程放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2 (红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 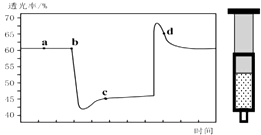
A.b点的操作是压缩注射器,平衡正向移动
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO22Mn2++5S +2H2O
B. 氯化铝溶液中加入过量氨水:Al3++4OH-AlO2+2H2O
C. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3- +2OH-![]() NH3↑+SO32+2H2O
NH3↑+SO32+2H2O
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com