
【题目】根据所学知识回答问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2═6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为(用离子方程表示)
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+ , 并有气体逸出,请写出相应的离子方程式:
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL5molL﹣1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+ , 则参加反应的铁粉的质量为 .
【答案】
(1)SO2和Fe3O4;32
(2)Fe3++3H2O?Fe(OH)3+3H+
(3)2Fe3++2I﹣=2Fe2++I2
(4)3Fe2++NO3﹣+4H+=3 Fe3++NO+2 H2O
(5)11.2g
【解析】解:(1)反应3FeS2+8O2=Fe3O4+6SO2 , 前后各元素化合价的变化情况如下: Fe:+2→+3,化合价升高;S:﹣1→+4,化合价升高;O:0→﹣2,化合价降低;因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol.所以答案是:SO2和Fe3O4;32;(2)Fe3+水解生成Fe(OH)3胶体可以净水,Fe3++3H2OFe(OH)3+3H+ , 所以答案是:Fe3++3H2OFe(OH)3+3H+;(3)氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应的离子方程式为2Fe3++2I﹣=2Fe2++I2 , 所以答案是:2Fe3++2I﹣=2Fe2++I2;(4)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=1K2SO4+3Fe2(SO4)3+2NO↑+4H2O,反应的离子方程式为3Fe2++NO3﹣+4 H+=3 Fe3++NO↑+2 H2O,所以答案是:3Fe2++NO3﹣+4H+=3 Fe3++NO+2 H2O;(5)氢气的物质的量为 0.1mol,
由关系式Fe~~~~2HCl~~~H2 , 得到
0.1mol0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为 ![]() ×(0.16L×5mol/L﹣0.2mol)=0.2mol,
×(0.16L×5mol/L﹣0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,所以答案是:11.2g.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.从溶液中结晶出来的晶体都含结晶水
B.晶体失去结晶水一定是风化的结杲
C.风化与潮解是两个正好相反的过程
D.某饱和溶液冷却析出晶体后,该溶液仍是饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物甲经氧化后得乙(分子式为C2H302C1),而甲经水解可得丙.1mol丙和2mol乙反应得一种含氯的酯(C6H804Cl2),由此推断甲的结构简式为( )
A.HCOOCH2Cl
B.ClCH2CH2OH
C.CH2ClCHO
D.HOCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求填空:
(1)下面列出了几组物质,请将物质的合适组号填写在空格上. 同位素 , 同素异形体 , 同分异构体 , 同系物 .
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);
⑤ 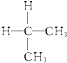 与
与 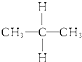 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦ ![]() 和
和 ![]() ;⑧
;⑧ ![]() 和
和 ![]() ;
;
(2)完成离子方程式:MnO4﹣+C2O42﹣+=Mn2++CO2↑+
(3)命名有机物: ![]()
(4)写出乙酸与甲醇(CH3OH)酯化的化学方程式 .
(5)将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池:通甲烷的铂丝为原电池的极,发生的电极反应为 .
(6)PET是涤纶的主要成分,可用作饮料瓶、磁带和胶片的片基等,其结构简式如图: ![]() .该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为和 .
.该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为;
(3)写出步骤③发生反应的离子方程式;
(4)步骤⑥的实验操作为、过滤、烘干.
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣被过量的氧化剂氧化所致.现给出以下试剂:1.0mol/L硫酸、1.0mol/LNaOH溶液、0.1mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合趣实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内的离子,在溶液中不能大量共存的是 ( )
A. Mg2+ K+ NO3- Cl- B. K+ Na+ Mg2+ SO42-
C. H+ SO42- Ba2+ NO3- D. Ca2+ H+ NO3- Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,气体全部逸出后,向溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol/L.(结果须化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2L的密闭容器中充入2molPCl3(g)和1molCl2(g),发生反应:PCl3(g)+Cl2(g)PCl5(g),5min达平衡,容器中的压强为开始时的 ![]() ,并且放出37.2kJ的热量,请回答下列问题:
,并且放出37.2kJ的热量,请回答下列问题:
(1)前5min内,v(Cl2)=molL﹣1min,此温度下,平衡常数K= .
(2)下列哪个图象能正确说明上述反应在进行到t1时刻时,达到平衡状态 . 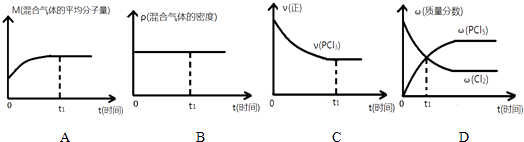
(3)平衡后,从容器中移走0.4molPCl3 , 0.2molCl2和0.2molPCl5 , 则平衡(填“正向移动”“逆向移动”或“不移动”),c(PCl3)(填“增大”“减小”或“不变”).
(4)相同条件下,若起始时,向2L的密闭容器中充入1molPCl3(g)和1molPCl5(g),反应达平衡后,理论上吸收 kJ的热量.
(5)PCl5与足量的水能完全反应生成H3PO4和HCl,将反应后的混合液逐滴加入到过量的Na2CO3溶液中,请写出可能发生反应的离子方程式 . (已知:H3PO4的电离平衡常数:Ka1=7.52×10﹣3 , Ka2=6.23×10﹣8 , Ka3=2.2×10﹣13;H2CO3的电离平衡常数:Ka1=4.3×10﹣7 , Ka2=5.61×10﹣11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com