
【题目】为检验某卤代烃(R-X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却。正确操作的先后顺序是( )
A.③①⑤⑥②④B.③①②⑥④⑤
C.③⑤①⑥④②D.①③⑤⑥②④
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是( )

A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇与乙酸在浓硫酸作用下的反应装置如图(酒精灯等在图中均已略去)。试管b中盛有________溶液。加热一段时间后,试管b溶液上方有一层油状液体,该油状液体的名称是_________。乙醇与乙酸反应的化学方程式为__________________________________
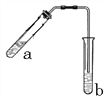
(2)某待测液中可能含有Al3+、Fe3+、Na+、NH4+、Cl-等离子,现通过如下实验对其中的阳离子进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中逐滴滴加NaOH溶液至过量,先有白色沉淀生成,后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_____,一定没有的阳离子是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备Cl2和新制的Cl2水,如图所示:

(1)装置中若无盛饱和食盐水的洗气瓶,将导致____________________。
(2)要证明Cl2与水反应是可逆反应,则证明Cl2水存在Cl2分子的现象是________,证明同时存在HCl和HClO的实验操作是_____________________。
(3)吸收Cl2尾气的化学反应方程式为________________________。
(4)用KClO3代替MnO2,不需加热就可以快速制得Cl2,该反应化学方程式为_____________________。
(5)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是___________________,它属于___________。
A. 酸性氧化物 B. 碱性氧化物 C. 酸酐 D.氯化物
(6)新制氯水中加入少量Na2CO3溶液有气体产生,该反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
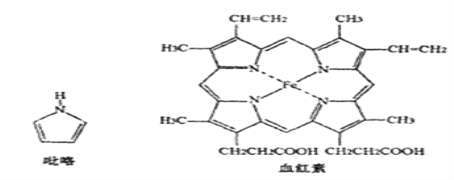
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
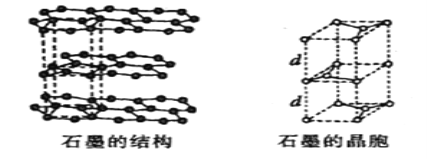
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在周期表中的相对位置如表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙>丁>戊
B.最外层电子数:甲>乙
C.金属性:甲<丙
D.氢氧化物碱性:丙>丁>戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com