
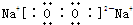 ;CB可与EA2反应生成C2A和气态物质EB4,该反应为4HF+SiO2═2H2O+SiF4↑,
;CB可与EA2反应生成C2A和气态物质EB4,该反应为4HF+SiO2═2H2O+SiF4↑,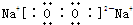 ;4HF+SiO2═2H2O+SiF4↑.
;4HF+SiO2═2H2O+SiF4↑.


科目:高中化学 来源: 题型:
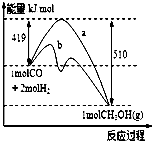 工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)
工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| N≡N | H-H | N-H | |
| 键能/kJ?mol-1 | 945 | 436 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,观察有无浅黄色沉淀 |
| B、加入NaOH溶液共热,滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| C、加入NaOH溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| D、加入NaOH、乙醇溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com