
| A、加入AgNO3溶液,观察有无浅黄色沉淀 |
| B、加入NaOH溶液共热,滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| C、加入NaOH溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| D、加入NaOH、乙醇溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
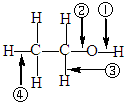
| A、与醋酸、浓硫酸共热时,②键断裂 |
| B、与金属钠反应时,①键断裂 |
| C、与浓硫酸共热至170℃时,②、④键断裂 |
| D、在Ag催化下与O2反应时,①、③键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH3、sp2平面三角形 |
| B、SO32-、sp2 平面三角形 |
| C、NO3-、sp3 三角锥形 |
| D、SO2、sp2V形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com