
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| ||
| 6min |
| 1.6mol |
| 4mol |
| 0.4mol |
| 2mol |
| [CO2]?[H2] |
| [H2O]?[CO] |
| 0.2×0.2 |
| 0.3×0.8 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60mL | B、90mL |
| C、120mL | D、150mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,观察有无浅黄色沉淀 |
| B、加入NaOH溶液共热,滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| C、加入NaOH溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
| D、加入NaOH、乙醇溶液共热,然后加稀硝酸呈酸性,再滴入AgNO3溶液,观察有无淡黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
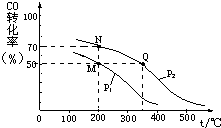 开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:
开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:
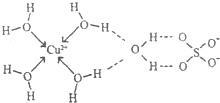 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用排饱和食盐水法收集Cl2 |
| B、增大压强有利于合成氨反应 |
| C、加入催化剂有利于氨的转化 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com