
| ||
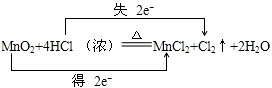 ,
, ;
;| 73g |
| 36.5g/mol |
| ||


科目:高中化学 来源: 题型:
| A、Na+、Ca2+、CO32- |
| B、Na+、Ca2+、HCO3- |
| C、H+、SO42-、OH- |
| D、H+、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间变化 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:1:2 |
| D、单位时间内消耗0.1 mol X同时生成0.2 mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用激光笔照射鸡蛋白水溶液 | 有丁达尔效应 | 鸡蛋白分子直径介于1nm~100nm |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 将气体X通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是CO2 |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔗糖溶于水中 |
| B、氢氧化钠溶于水 |
| C、用压强计测某一深度处的水压 |
| D、稀释浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
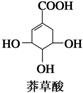
| A、能使FeCl3溶液显色 |
| B、分子中含有2种官能团 |
| C、可发生加成和取代反应 |
| D、分子中所有原子可以共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com