
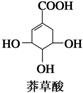
| A、能使FeCl3溶液显色 |
| B、分子中含有2种官能团 |
| C、可发生加成和取代反应 |
| D、分子中所有原子可以共平面 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用排饱和食盐水法收集Cl2 |
| B、增大压强有利于合成氨反应 |
| C、加入催化剂有利于氨的转化 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(1)△H=-285.8kJ/mol | ||
B、H2(g)+
| ||
| C、2H2 (g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | ||
| D、2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、OH- |
| B、H+、Cl- |
| C、Fe3+、Cl- |
| D、Fe3+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚二氧化碳塑料是合成高分子材料 |
| B、聚二氧化碳塑料与干冰互为同素异形体 |
| C、聚二氧化碳塑料的使用也会产生白色污染 |
| D、聚二氧化碳塑料与干冰是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.448×1025个 |
| B、7.260×1024个 |
| C、2.408×1024个 |
| D、1.806×1025个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com