
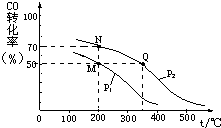
 开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:
开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl═NaHCO3+NaCl |
| B、用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl═NaCl+CO2↑+H2O |
| C、可用碱式滴定管量取所需要的Na2CO3溶液 |
| D、若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔗糖溶于水中 |
| B、氢氧化钠溶于水 |
| C、用压强计测某一深度处的水压 |
| D、稀释浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、酸与碱恰好完全反应生成正盐的溶液 |
| C、使石蕊试液呈紫色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道 |
| B、杂化轨道的数目与杂化前的轨道数目可以相等,也可以不等 |
| C、杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理 |
| D、杂化轨道只能用于形成σ键或容纳孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| B、任何浓度的溶液都可以用pH来表示其酸性的强弱 |
| C、无论是纯水、酸性、碱性或中性稀溶液,常温下,其c(H+)?c(OH-)=1×10-14 |
| D、0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com