
| A、pH=7的溶液 |
| B、酸与碱恰好完全反应生成正盐的溶液 |
| C、使石蕊试液呈紫色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L溶液 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
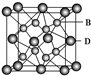 有A、B、C、D、E五种元素,其相关信息如下:
有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+2BaSO4↓+NH3?H2O+2H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D、向NH4HCO3溶液中加过量的NaOH溶液并加热NH4++OH-═△NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 化合物 | NH3 | NaOH | Cu2(OH)2CO3 | FeSO4?7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 盐酸 | 蔗糖 | 胆矾晶体 | 铁 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60mL | B、90mL |
| C、120mL | D、150mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
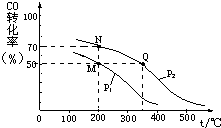 开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:
开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2p和3p轨道形状均为哑铃形,能量也相等 |
| B、M层有3个能级,9个轨道 |
| C、第四周期最外层电子数为1,且内层电子全部排满的原子是钾原子 |
| D、在离核最近区域内运动的电子能量最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com