
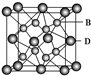
 有A、B、C、D、E五种元素,其相关信息如下:
有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
| 5-3 |
| 2 |
 ,
, ;NH4H+H2O=NH3?H2O+H2↑;
;NH4H+H2O=NH3?H2O+H2↑;| 1 |
| 8 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
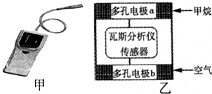 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在无色溶液中:NH4+、Fe2+、SO42-、CO32- |
| B、加铝粉产生氢气的溶液中:NH4+、NO3?、Cl?、Ba2+ |
| C、在pH=1的溶液中:K+、Fe2+、Cl-、CH3COO- |
| D、含有0.1 mol?L-1H2SO4的溶液中:K+、Mg2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 含量 编号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| ① | 0.3mol | 0.2mol | 0.1mol | - |
| ② | 0.1mol | 0.3mol | - | 0.1mol |
| A、仅n(K+)相同 |
| B、仅n(Cl-)相同 |
| C、不完全相同 |
| D、完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl═NaHCO3+NaCl |
| B、用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl═NaCl+CO2↑+H2O |
| C、可用碱式滴定管量取所需要的Na2CO3溶液 |
| D、若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、酸与碱恰好完全反应生成正盐的溶液 |
| C、使石蕊试液呈紫色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com