
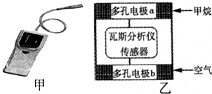
 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
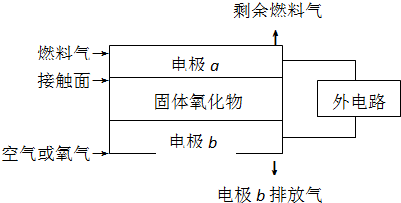
| A、电极b为电池负极,电极反应式为2O2+4e-=4O2- |
| B、固体氧化物的作用是让电子在电池内通过 |
| C、若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O |
| D、若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+的电子排布式:1s22s22p63s1 |
| B、Fe的简化电子排布式:[Ar]4s2 |
| C、Cr的外围电子排布式:3d54s1 |
D、N的最外层电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量比后者少 |
| B、由C(石墨)=C(金刚石);△H=+1.90 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(1);△H=一57.3 kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的分子个数比为1:1 |
| B、它们的原子个数比为5:4 |
| C、它们的电子个数比为1:1 |
| D、它们的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种元素,其相关信息如下:
有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com