
| ||
| 1000ρω |
| M |
| 11.7g |
| 58.5g/mol |
| 10g×98% |
| 98g/mol |
| ||
| 3.65g |
| 103.65g |
| 1000×1.05×3.52% |
| 36.5 |


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
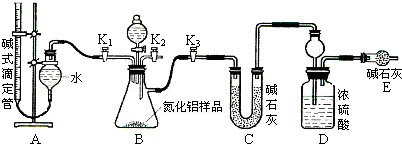
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(Ⅰ)(Ⅱ)产物均相同 |
| B、(Ⅰ)(Ⅱ)产物均不同 |
| C、(Ⅰ)产物相同,(Ⅱ)产物不同 |
| D、(Ⅰ)产物不同,(Ⅱ)产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极反应:3O2+6e-+6H+=3H2O2 |
| B、氧化性:O2>O3 |
| C、电解一段时间后,溶液pH下降 |
| D、每转移3 mol电子,可生成标准状况下22.4 L O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体是阳离子和阴离子通过静电吸引力结合而成的晶体 |
| B、晶格能由大到小:NaF>NaCl>NaBr>NaI |
| C、硬度:MgO>CaO>BaO |
| D、在氯化钠晶体中,Na+和Cl-的配位数均为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
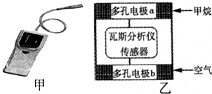 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com