
| A、离子晶体是阳离子和阴离子通过静电吸引力结合而成的晶体 |
| B、晶格能由大到小:NaF>NaCl>NaBr>NaI |
| C、硬度:MgO>CaO>BaO |
| D、在氯化钠晶体中,Na+和Cl-的配位数均为6 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体中只要有阳离子就一定有阴离子 |
| B、金刚石和冰在熔化时克服的作用力相同 |
| C、HCl晶体由H+和Cl-构成 |
| D、原子晶体里,所有原子都以共价键相互结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有主族非金属元素,都有最高正价且等于其最外层电子数 |
| B、单原子形成的离子,一定具有稀有气体原子的核外电子排布 |
| C、某元素原子最外层电子数有2个,则该元素一定是第ⅡA族的元素 |
| D、两种单原子,若核外电子排布完全相同,则一定属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
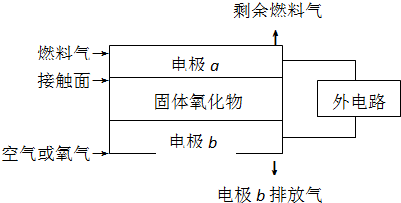
| A、电极b为电池负极,电极反应式为2O2+4e-=4O2- |
| B、固体氧化物的作用是让电子在电池内通过 |
| C、若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O |
| D、若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com