
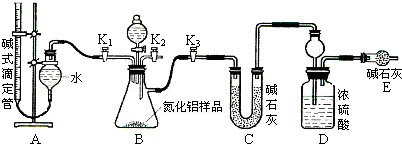
| z-y |
| 17 |
| z-y |
| 17 |
| 41(z-y) |
| 17 |
| ||
| x |
| 41(z-y) |
| 17x |
| 41(z-y) |
| 17x |
| (b-a)×10 -3 |
| Vm |
| 1 |
| 3 |
| (b-a)×10 -3 |
| Vm |
| 48(b-a)×10 -3 |
| Vm |
| 0.048(a-b) |
| Vm?x |
| 0.048(a-b) |
| Vm?x |


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、钠原子有强还原性,钠离子有弱氧化性 |
| B、若电解熔融的氯化钠,则钠离子被氧化成钠原子 |
| C、钠很活泼,在一定条件下可以置换出金属活动性顺序表钠后面的金属 |
| D、钠是电和热的良导体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
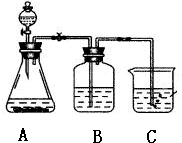 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
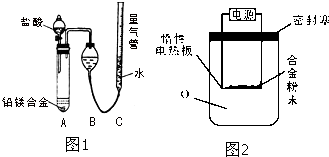 为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.| NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2参加反应转移的电子数为NA |
| B、在0℃,101kPa时,22.4L氢气中含有2NA个氢原子 |
| C、1molO2的质量为32g/mol |
| D、2molHCl溶解在1L水中得到盐酸溶液的物质的量浓度为2mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com