
| A、等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量比后者少 |
| B、由C(石墨)=C(金刚石);△H=+1.90 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(1);△H=一57.3 kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾霾天气严重危害人体健康,而形成雾霾天气的“罪魁祸首”是PM2.5 |
| B、地沟油,潲水油在餐饮企业中不能使用,但却可以用于制肥皂,变废为宝 |
| C、天宫一号使用的碳纤维是一种新型无机高分子材 料 |
| D、纤维素能在人体内水解,生成的葡萄糖能为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素B、C、D具有相同电子层结构的离子,其半径依次增大 |
| B、元素A不能与元素B形成化合物A2B2 |
| C、元素B、E分别与元素A形成的化合物的热稳定性:Am>AmE |
| D、元素D、E的最高价氧化物的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
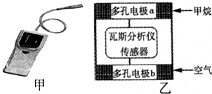 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.24g | B、0.64g |
| C、0.4g | D、1.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com