
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
【答案】2.24 3.36 64g/mol 32 2.80 6.72 64:71 71:64
【解析】
(1)标况下气体摩尔体积=22.4L/mol,根据V=n·Vm=![]() ·Vm计算氨气体积;氨气分子与硫化氢分子中H原子个数之比为3:2,要使两种气体中H原子个数相等,则其物质的量之比为2:3;
·Vm计算氨气体积;氨气分子与硫化氢分子中H原子个数之比为3:2,要使两种气体中H原子个数相等,则其物质的量之比为2:3;
(2)根据n=![]() 计算气体的物质的量,结合n=
计算气体的物质的量,结合n=![]() 计算该氧化物的摩尔质量;其摩尔质量在数值上等于其相对分子质量;
计算该氧化物的摩尔质量;其摩尔质量在数值上等于其相对分子质量;
(3)根据n=![]() 、n=
、n=![]() ,并利用混合气体的质量和物质的量来列式计算;
,并利用混合气体的质量和物质的量来列式计算;
(4)根据ρ=![]() 可知:同温同压下,气体的密度之比等于摩尔质量之比;相同质量时,体积与摩尔质量成反比。
可知:同温同压下,气体的密度之比等于摩尔质量之比;相同质量时,体积与摩尔质量成反比。
(1)n=![]() =0.1mol,标况下气体摩尔体积=22.4L/mol,则V(NH3)=n·Vm=0.1mol×22.4L/mol=2.24L;
=0.1mol,标况下气体摩尔体积=22.4L/mol,则V(NH3)=n·Vm=0.1mol×22.4L/mol=2.24L;
NH3分子与H2S分子中H原子个数之比为3:2,要使两种气体中H原子个数相等,则其物质的量之比为2:3,则H2S气体物质的量n(H2S)=![]() n(NH3)=
n(NH3)=![]() ×0.1mol=0.15mol,其在标准状况下的体积V(H2S)=0.15mol×22.4L/mol=3.36L;
×0.1mol=0.15mol,其在标准状况下的体积V(H2S)=0.15mol×22.4L/mol=3.36L;
(2)n=![]() =0.02mol,由n=
=0.02mol,由n=![]() 可知该氧化物的摩尔质量M=
可知该氧化物的摩尔质量M=![]() =64g/mol,当摩尔质量以g/mol为单位时,在数值上等于其相对分子质量,则气态氧化物RO2的相对分子质量是64,R相对原子质量=64-16×2=32;
=64g/mol,当摩尔质量以g/mol为单位时,在数值上等于其相对分子质量,则气态氧化物RO2的相对分子质量是64,R相对原子质量=64-16×2=32;
(3)标准状况下混合气体体积为8.96L,则气体的物质的量n=![]() =0.4mol,设混合气体中CO、CO2的物质的量分别为x、y,则x+y=0.4,28x+44y=16.0,解得x=0.1mol,y=0.3mol,CO的质量m(CO)=nM=0.1mol×28g/mol=2.80g,CO2在标准状况下的体积V(CO2)=n·Vm=0.3mol×22.4L/mol=6.72L;
=0.4mol,设混合气体中CO、CO2的物质的量分别为x、y,则x+y=0.4,28x+44y=16.0,解得x=0.1mol,y=0.3mol,CO的质量m(CO)=nM=0.1mol×28g/mol=2.80g,CO2在标准状况下的体积V(CO2)=n·Vm=0.3mol×22.4L/mol=6.72L;
(4)同温同压下,气体的密度之比等于摩尔质量之比,则SO2与Cl2的密度之比为ρ(SO2):ρ(Cl2)=64g/mol:71g/mol=64:71;
当气体质量相同时,气体的体积与其摩尔质量成反比,则质量相同,两种气体的体积比V(SO2):V(Cl2)=71g/mol:64g/mol=71:64。


科目:高中化学 来源: 题型:
【题目】Ⅰ、秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。巴蜀中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制250mL上述浓度的消毒液:
①需要用托盘天平称量NaClO固体的质量为_______g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________。
(3)实验过程中下列操作或说法不正确的是_____。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
(4)经过查阅资料,测定所配消毒液中NaClO的物质的量浓度的方法如下:准确取出10.00mL消毒液稀释至1000.00mL,量取稀释液20.00mL于锥形瓶中,加入过量的NaI溶液,用足量的醋酸酸化,充分反应后向溶液中滴加0.0500 mol/L Na2S2O3溶液,完全反应时消耗Na2S2O3溶液30.40mL。反应过程中的相关化学方程式为: ![]()
![]() ,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
Ⅱ、某工厂的工业废水中含有大量FeSO4,较多的CuSO4和少量的Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。请根据下列流程,完成实验方案(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液)
(1)操作a的名称为____,所需的玻璃仪器有_____。
(2)固体E的成分为____(填化学式),加入的试剂④为_________。
(3)加入试剂①的目的是__________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为_______,过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为:MnO4-+NO2-+ →Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中NO2-被还原B.反应过程中溶液的酸性增强
C.生成1 mol NaNO3需消耗0.4 mol KMnO4D.方程式中缺少的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示能量变化,分析下列说法正确的是

A.A(g)+B(g)→C(g)+D(l)是放热反应
B.A(g)+B(g)→C(g)+D(l)是吸热反应
C.C(g)+D(l)→A(g)+B(g)是放热反应
D.A(g)+B(g)具有的能量小于C(g)+D(l)具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
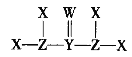
A.X与Z可形成质子数、电子数均相同的ZX3、![]()
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol乙醛分子中含有σ键的数目为________,乙酸的沸点明显高于乙醛,其主要原因是____________________________________________。
(2)与OH-互为等电子体的一种分子为________________(填化学式)。
(3)短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
①C元素原子基态时的价电子排布式为________,若A元素为非金属元素,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
②当n=2时,B的最简单气态氢化物的分子构型为________,中心原子的杂化方式为________,BC2属于________分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于________晶体。
(4)BF3与一定量的水形成晶体Q[(H2O)2·BF3],Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(5)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A.a点是CaSO4的饱和溶液而b点不是
B.蒸发水可使溶液由b点变化到a点
C.常温下,CaCO3(s)+![]() (aq)
(aq)![]() CaSO4(s)+
CaSO4(s)+![]() (aq)的K=3.1×10-4
(aq)的K=3.1×10-4
D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学分别用下列装置a和b制备溴苯,下列说法错误的是

A.两烧瓶中均出现红棕色气体,说明液溴沸点低
B.a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应
C.b装置试管中CCl4吸收Br2,液体变红棕色
D.b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com