
【题目】NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为:MnO4-+NO2-+ →Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中NO2-被还原B.反应过程中溶液的酸性增强
C.生成1 mol NaNO3需消耗0.4 mol KMnO4D.方程式中缺少的粒子是OH-
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】150℃时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体物质的质量增加了3.6g,则原混合气体中CO2与H2O的物质的量之比是( )
A.1:4B.3:11C.1:11D.21:22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究盐酸和NaOH反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )

A.A点时溶液呈酸性
B.B点表示盐酸和NaOH恰好完全反应
C.C点时,溶液中的溶质只有氯化钠
D.该实验是将NaOH溶液滴入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:![]() ,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
A.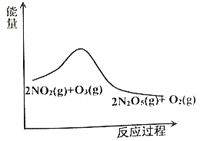 B.
B.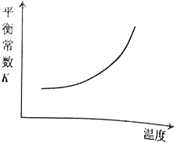
C.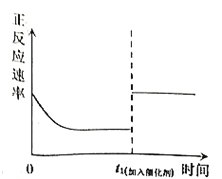 D.
D.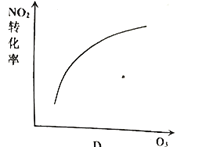
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
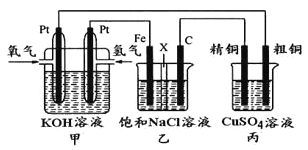
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________(填“正极”或“负极”),负极的电极反应式为_________________。
(2)乙装置中铁电极为_______(填“阳极”或“阴极”),石墨电极(C)上发生_____反应(填“氧化”或“还原”),其电极反应式为___________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____;丙装置中阴极析出铜的质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL-1,SO42-的物质的量浓度为0.3molL-1,则混合液中K+的物质的量浓度为______________ molL-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com