
【题目】Ⅰ、秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。巴蜀中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制250mL上述浓度的消毒液:
①需要用托盘天平称量NaClO固体的质量为_______g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________。
(3)实验过程中下列操作或说法不正确的是_____。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
(4)经过查阅资料,测定所配消毒液中NaClO的物质的量浓度的方法如下:准确取出10.00mL消毒液稀释至1000.00mL,量取稀释液20.00mL于锥形瓶中,加入过量的NaI溶液,用足量的醋酸酸化,充分反应后向溶液中滴加0.0500 mol/L Na2S2O3溶液,完全反应时消耗Na2S2O3溶液30.40mL。反应过程中的相关化学方程式为: ![]()
![]() ,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
Ⅱ、某工厂的工业废水中含有大量FeSO4,较多的CuSO4和少量的Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。请根据下列流程,完成实验方案(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液)
(1)操作a的名称为____,所需的玻璃仪器有_____。
(2)固体E的成分为____(填化学式),加入的试剂④为_________。
(3)加入试剂①的目的是__________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为_______,过滤,洗涤,干燥。
【答案】4.0 74.5 250mL容量瓶、胶头滴管 ACD 3.8 过滤 漏斗、玻璃棒、烧杯 Fe和Cu 稀硫酸 将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离 蒸发浓缩,冷却结晶
【解析】
I.根据质量分数计算物质的量浓度;根据溶液配制原理分析实验所需仪器,并进行误差分析;
II.先加过量碱,过滤得到Cu(OH)2,Fe(OH)2沉淀,滤液是Na2SO4、NaOH溶液,在Cu(OH)2,Fe(OH)2中加过量稀H2SO4,溶液C的成分为CuSO4,FeSO4、H2SO4;在溶液中加过量铁,过滤出Fe、Cu,滤液D是FeSO4,在固体E中加过量稀H2SO4,过滤出Cu,实现了回收金属铜,滤液是FeSO4、H2SO4,最后溶液合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO47H2O,回收硫酸亚铁,以此解答该题。
I.(1)c(NaClO)=![]() ,故答案为:4.0;
,故答案为:4.0;
(2)①m(NaClO)=0.25L×4mol/L×74.5g/mol=74.5g;②配制过程中还需要250mL容量瓶和胶头滴管,故答案为:74.5;250mL容量瓶、胶头滴管;
(3)A、容量瓶用蒸馏水洗净之后,不需要烘干,可以直接进行配制溶液,故A错误;
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,损失了溶质,会导致所得溶液浓度偏低,故B正确;
C、定容时,俯视刻度线会使溶液体积偏小,则会导致所得溶液浓度偏大,故C错误;
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切会使溶液浓度偏低,故D错误;故答案为:ACD;
(4)NaClO~I2~2Na2S2O3,n(NaClO)=1/2n(Na2S2O3)=1/2×0.0500 mol/L×30.40mL×10-3=0.00076mol,则c(NaClO)=![]() =3.8mol/L,故答案为:3.8mol/L。
=3.8mol/L,故答案为:3.8mol/L。
II.(1)操作a为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)固体E为Fe和Cu,可加入硫酸,故答案为:Fe和Cu;稀硫酸;
(3)试剂①应为氢氧化钠,可将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离,故答案为:将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离;
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶。


科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
A. 0.01 mol·L-1HA的溶液中c(H+)=1×10-4mol·L-1
B. pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C. 浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-)
D. pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体物质的质量增加了3.6g,则原混合气体中CO2与H2O的物质的量之比是( )
A.1:4B.3:11C.1:11D.21:22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池构造如图所示,工作时(需先引发Fe 和KClO3的反应,从而使 LiCl-KCl共晶盐熔化),某电极(记为X )的反应式之一为:xLi++ xe- +LiV3O8=Lii+xV3O8。下列说法正确的是

A.放电时,正极的电极反应式为: Li – e- = Li+
B.放电时,总反应式为:xLi + LiV3O8 = Lii+xV3O8
C.充电时,X电极与外接电源负极相连
D.充电时,X电极的质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究盐酸和NaOH反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )

A.A点时溶液呈酸性
B.B点表示盐酸和NaOH恰好完全反应
C.C点时,溶液中的溶质只有氯化钠
D.该实验是将NaOH溶液滴入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:![]() ,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
A.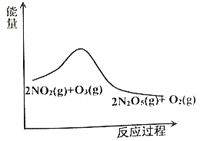 B.
B.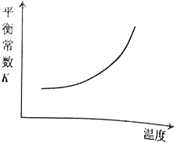
C.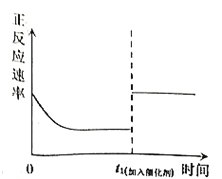 D.
D.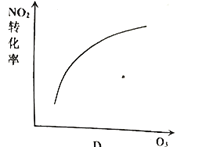
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com