

分析 废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体,
(1)实现固体和液体的分离用过滤的方法;
(2)根据水解原理:盐+水=酸+碱,结合水解产物是TiO2•xH2O来书写;
(3)根据氧化还原方程式并结合概念确定氧化剂和还原剂,进而确定物质的量之比;
(4)根据沉淀溶解平衡的移动以及碳酸根离子乳酸之间反应的原理来回答;
(5)亚铁离子可以和碳酸氢根离子之间反应生成碳酸亚铁沉淀;
(6)亚铁离子易被氧气氧化;
(7)根据元素守恒和电子守恒计算FeSO4•7H2O的质量分数.
解答 解:(1)分离硫酸亚铁溶液和滤渣的操作是过滤,故答案为:过滤;
(2)TiOSO4水解生成TiO2•xH2O的化学方程式为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4,
故答案为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4;
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:4FeSO4+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO3,氧化剂是氧气,还原剂是氧化铁,所以氧化剂和还原剂的物质的量之比为1:4,
故答案为:1:4;
(4)根据碳酸铁的沉淀溶解平衡原理:FeCO3(s)?Fe2+(aq)+CO32-(aq),加入乳酸,这样CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,
故答案为:FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(5)步骤④的离子方程式是Fe2++2HCO3-═FeCO3↓+H2O+CO2↑,
故答案为:Fe2++2HCO3-═FeCO3↓+H2O+CO2↑;
(6)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(7)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,即5FeSO4•7H2O~KMnO4,根据消耗0.1000mol•L-1 KMnO4溶液20.00mL,所以晶体中FeSO4•7H2O的质量分数=$\frac{0.1000mol/L×0.02L×5×5×278g/mol}{a}$×100%=$\frac{13.9}{a}$,故答案为:$\frac{13.9}{a}$.
点评 考查分离提纯的操作简单;水解离子方程式的书写要用到题中所给信息;陌生离子方程式的书写要从化工工艺流程中获取有用信息,对学生的要求较高;对氧化还原反应的考查较多,特别是定量计算,寻找关系式,都要用到得失电子守恒,化合价升降总数相等的知识,氧化还原反应的滴定是一个难点.平衡移动的知识考查了溶解平衡的知识,难度适中.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏、煤的气化、煤的干馏、海水制盐等都属于化学变化过程 | |
| B. | 在牙膏中添加Na2PO3F、NaF能防治龋齿,当提供的F-浓度相等时,它们防治龋齿的作用是相同的 | |
| C. | NO2、SO2、CO2、PM2.5都是空气质量日报必须报道的大气污染物 | |
| D. | 家用天然气含有特殊气味的主要原因是开采的天然气未经处理就直接转为民用燃气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
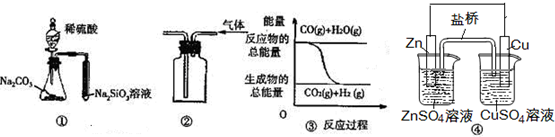
| A. | 图 ④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图 ④中的原电池装置反应不相同 | |
| B. | 用图 ②所示实验装置排空气法收集H2气体 | |
| C. | 图 ③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
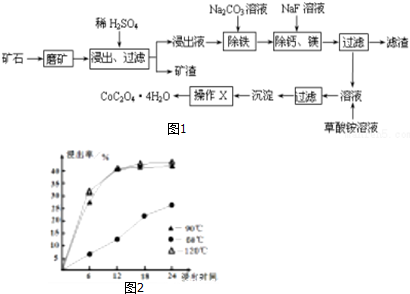
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com