
【题目】某芳香烃的分子式为C10H14,它不能使溴水褪色,可使酸性KMnO4溶液褪色,分子结构中只含有一个侧链,符合条件的烃有( )
A.2种B.3种C.4种D.5种
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置______________________________________________
(2)F元素的最高价氧化物对应的水化物的化学式为___________________________________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:__________________________________________________。
C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________________________。
(5)C、E的氢化物,沸点由高到低顺序是:_______________________________。
(6)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_______________。当转移电子为0.2mol时,标准状况下反应产生气体_______________L。
(7)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图为其工作原理和废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
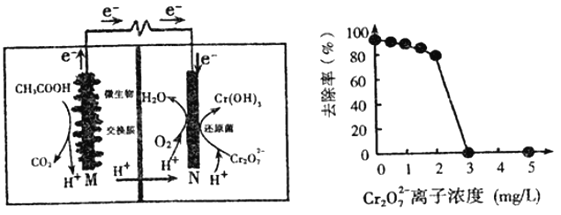
A. 反应一段时间后,N极附近的溶液pH下降
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. M为电池正极,CH3COOH被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A. 当混合气体平均相对分子质量为26时说明该反应已达平衡
B. 达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
C. 根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D. 因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在高温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入 M 的浓溶液,一段时间后, 下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A. 当 M为盐酸、杠杆为导体时,A 端高,B 端低
B. 当 M为 AgNO3、杠杆为导体时,A 端高,B 端低
C. 当 M为 CuSO4、杠杆为导体时,A 端低,B 端高
D. 当 M为 CuSO4、杠杆为绝缘体时,A 端低,B 端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com