
【题目】下列物质中,属于电解质,但在液态时不导电的是 ( )
A.Na2OB.KAl(SO4)2·12H2OC.HClD.BaSO4
科目:高中化学 来源: 题型:
【题目】现有24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g)N2O3(g)+O2(g)
②N2O3(g)N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5 , 加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7
B.8.5
C.9.6
D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列说法不正确的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次减小
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32﹣)
C.b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的45倍。NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。实际工业生产中可用硫黄、浓硫酸代替反应原料中的SO2,其原因是_________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的是_________________。
(3)吸收器中生成NaClO2反应的离子方程式为_________________,吸收器中的反应温度不能过高,可能的原因为_________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应。

①为除去过量的SO2,C中盛放的试剂为___________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内肯定发生反应的化学方程式为_________________。
③有同学认为B中硬质玻璃管内可能还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

同学们经过讨论,认为上述方案不合理,其理由是:a.____________;b.____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为____。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为____(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为__________,K的原子结构示意图为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为__________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为____;
②该产气药剂中NaN3的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 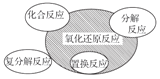 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系
B.  AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况
C.  Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况
D.  等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,相关反应如下:
① NH3 +HClO===NH2Cl+H2O ② NH2Cl+HClO===NHCl2+H2O ③ 2NHCl2 +H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是
(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是

A. 次氯酸与氨的总反应可表示为:2NH3+3HClO===N2+3H2O+3HCl
B. 反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为1.5
C. a点之前溶液中发生的主要反应为:NH2Cl+HClO===NHCl2+H2O
D. 次氯酸钠溶液pH较小时有O2生成,促使氨氮去除率提高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com