
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:不详 题型:单选题
| A.能量守恒原理 |
| B.近似能级图中的顺序 3d 轨道能量比 4s 轨道高 |
| C.洪特规则 |
| D.泡利不相容原理 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.42He原子核内含有2个质子 |
| B.32He和42He互为同位素 |
| C.32He原子核内含有1个中子 |
| D.42He的最外层电子数为2,所以42He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
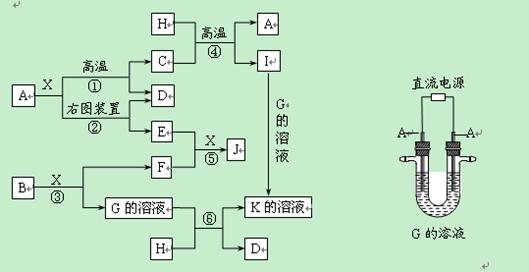
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
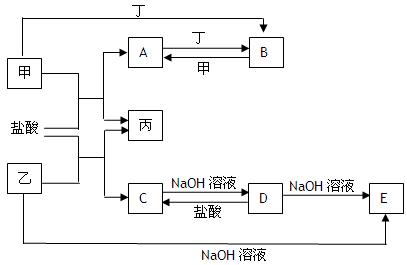
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
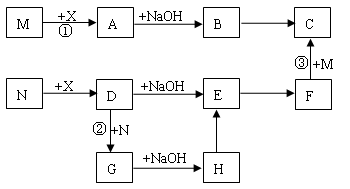
 2)画出X的组成元素原子结构简图 ▲ 。
2)画出X的组成元素原子结构简图 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Z、T、X、Y、 | B.Y、X、Z、T | C.X、Y、T、Z | D.Y、X、T、Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com